Karakteristik komparatif dari penghambatan kompetitif dan non-kompetitif. Penghambat enzim. Regulasi umpan balik
Ada perbedaan antara penghambatan reversibel dan ireversibel. Jika suatu inhibitor menyebabkan perubahan terus-menerus pada struktur tersier spasial molekul enzim atau modifikasi gugus fungsi enzim, maka jenis penghambatan ini disebut ireversibel. Namun, lebih sering terjadi penghambatan reversibel, yang dapat diukur menggunakan persamaan Michaelis-Menten. Penghambatan reversibel, pada gilirannya, dibagi menjadi kompetitif dan non-kompetitif, tergantung pada apakah penghambatan reaksi enzimatik dapat diatasi atau tidak dengan meningkatkan konsentrasi substrat.
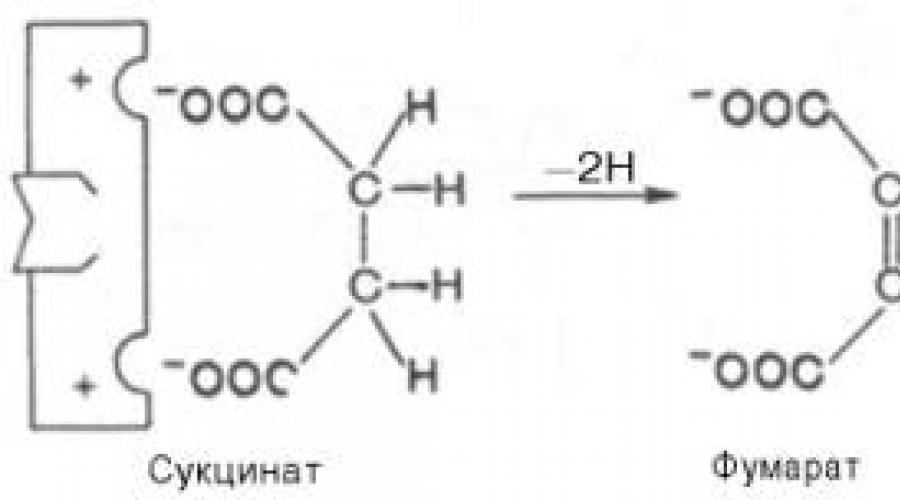
Penghambatan kompetitif dapat disebabkan oleh zat yang mempunyai struktur serupa dengan substrat, namun sedikit berbeda dengan struktur substrat sebenarnya. Penghambatan ini didasarkan pada pengikatan inhibitor ke situs pengikatan substrat (aktif). Contoh klasik dari jenis penghambatan ini adalah penghambatan suksinat dehidrogenase (SDH) oleh asam malonat. Enzim ini mengkatalisis oksidasi melalui dehidrogenasi asam suksinat(suksinat) menjadi fumarat:
Jika malonat (inhibitor) ditambahkan ke dalam medium, maka karena kemiripan strukturnya dengan substrat suksinat yang sebenarnya (adanya dua gugus karboksil terionisasi yang sama), ia akan berinteraksi dengan pusat aktif membentuk enzim-inhibitor. kompleks, namun transfer atom hidrogen dari malonat dihilangkan sepenuhnya. Struktur substrat (suksinat) dan inhibitor (malonat) masih agak berbeda. Oleh karena itu, mereka bersaing untuk mengikat situs aktif, dan tingkat penghambatan akan ditentukan oleh rasio konsentrasi malonat dan suksinat, dan bukan oleh konsentrasi absolut inhibitor. Dengan demikian, inhibitor dapat berikatan secara reversibel dengan bola, membentuk kompleks enzim-inhibitor. Jenis penghambatan ini kadang-kadang disebut penghambatan antagonisme metabolik (Gbr. 4.20).
DI DALAM bentuk umum reaksi antara inhibitor dan enzim dapat direpresentasikan dengan persamaan berikut:
Kompleks yang dihasilkan, disebut kompleks enzim-inhibitor EI, tidak seperti kompleks enzim-substrat ES, tidak terurai membentuk produk reaksi. Konstanta disosiasi kompleks EI, atau konstanta penghambatan K i, mengikuti teori Michaelis – Menten, dapat didefinisikan sebagai rasio konstanta reaksi balik dan reaksi maju:
Metode penghambatan kompetitif telah diterapkan secara luas dalam praktik medis. Diketahui, misalnya, untuk pengobatan beberapa orang penyakit menular disebabkan oleh bakteri, digunakan obat sulfonamida. Ternyata obat ini secara struktural mirip dengan asam para-aminobenzoat, yang digunakan sel bakteri untuk mensintesis asam folat, yaitu bagian yang tidak terpisahkan
Beras. 4.20. Aksi inhibitor kompetitif (skema menurut V.L. Kretovich). E - enzim; S - substrat; P 1 dan P 2 - produk reaksi; saya - penghambat.
enzim bakteri. Karena kesamaan struktural ini, sulfonamida menghambat kerja enzim dengan menggantikan asam para-aminobenzoat dari kompleks dengan enzim yang mensintesisnya. asam folat, yang menyebabkan terhambatnya pertumbuhan bakteri.
Penghambatan non-kompetitif disebabkan oleh zat yang secara struktural tidak mirip dengan substrat dan seringkali tidak berikatan pada pusat aktif, tetapi di tempat lain dalam molekul enzim. Tingkat penghambatan dalam banyak kasus ditentukan oleh durasi kerja inhibitor pada enzim. Dengan adanya penghambatan jenis ini, terjadi akibat terbentuknya suatu stabil Ikatan kovalen enzim sering mengalami inaktivasi total, dan kemudian penghambatan menjadi tidak dapat diubah. Contoh penghambatan ireversibel adalah pengaruh iodoasetat, DPP, serta dietil-n-nitrofenil fosfat dan garam. asam hidrosianat. Tindakan ini terdiri dari pengikatan dan pemutusan gugus fungsi atau ion logam dan molekul enzim.
Daftar isi topik "Penghambatan. Sel.":
Dalam hal ini, zat yang serupa sifatnya struktur ke substrat enzim umum, berikatan dengan sisi aktif enzim, tetapi tidak dapat bereaksi dengannya. Berada di sini, ia memblokir akses ke pusat aktif ke molekul substrat nyata.
Karena dalam hal ini inhibitor dan substrat bersaing untuk mendapatkan ruang situs aktif enzim Bentuk penghambatan ini disebut penghambatan kompetitif. Ciri khas dari penghambatan kompetitif adalah jika konsentrasi substrat meningkat, maka laju reaksi meningkat, yaitu penghambatan ini bersifat reversibel.
Gambar tersebut mengilustrasikan salah satu contoh penghambatan kompetitif.
Fenomena penghambatan kompetitif membantu untuk memahami mekanisme kerja obat tertentu, khususnya sulfonamid. Tujuan dari kemoterapi adalah untuk menghancurkan dengan bantuan tertentu bahan kimia patogen tanpa merusak jaringan inang. Obat pertama adalah sulfonamid, yang efek antibakterinya ditemukan pada tahun 30-an abad ke-20. Selama Perang Dunia II mereka banyak digunakan untuk memerangi infeksi luka. Sulfonamida memiliki sifat kimia yang mirip dengan asam para-aminobenzoat (PABA), yang merupakan faktor pertumbuhan penting bagi banyak orang bakteri patogen. PABA dibutuhkan oleh bakteri untuk sintesis asam folat, yang berfungsi sebagai salah satu kofaktor enzimnya. Sulfonamida menghambat salah satu enzim yang terlibat dalam sintesis asam folat dari PABA.
Sel hewan tidak sensitif terhadap sulfonamid, meskipun mereka memerlukan asam folat untuk beberapa reaksi. Hal ini dijelaskan oleh fakta bahwa mereka menggunakan asam folat yang sudah terbentuk; Mereka tidak memiliki jalur metabolisme yang dapat menjamin sintesisnya.
Penghambatan reversibel non-kompetitif
Inhibitor jenis ini strukturnya tidak berhubungan dengan substrat enzim ini; Dalam hal ini, bukan pusat aktif enzim yang terlibat dalam pembentukan kompleks dengan inhibitor, tetapi bagian lain dari molekulnya. Hal ini tidak menghalangi substrat untuk bergabung dengan enzim, namun membuat katalisis tidak mungkin dilakukan.
Dengan promosi konsentrasi inhibitor laju reaksi semakin menurun. Pada saat jenuh dengan inhibitor, ternyata hampir sama dengan nol. Berbeda dengan penghambatan kompetitif, dalam hal ini peningkatan konsentrasi substrat tidak mempengaruhi laju reaksi.
Inhibisi
- Ini adalah penghambatan aktivitas enzim. Dalam hal ini, denaturasi enzim tidak terjadi.
penghambat - zat yang menyebabkannya spesifik aktivitas menurun enzim. Asam anorganik dan logam berat bukanlah inhibitor, melainkan inhibitor inaktivator, karena mereka mengurangi aktivitas enzim apa pun, mis. bertindak tidak spesifik Selain itu, zat pendenaturasi tidak diklasifikasikan sebagai inhibitor.
Inhibitor: ion atau molekul kecil yang merupakan bagian dari sistem pengaturan enzim, serta obat farmakologis.
Menurut kekuatan pengikatan enzim dengan inhibitor, terjadi penghambatan dapat dibalik Dan tidak dapat diubah.
Sehubungan dengan inhibitor terhadap situs aktif enzim, penghambatan dibagi menjadi kompetitif Dan tidak kompetitif.
Jenis penghambatan
1. Dapat dibalik 2. Tidak dapat diubah
A. KOMPETITIF A. KHUSUS
B. NON KOMPETISI B. NON KHUSUS
Penghambatan yang dapat dibalik. Kebanyakan inhibitor bertindak secara reversibel, membentuk ikatan non-kovalen dengan enzim, dan dalam kondisi tertentu berdisosiasi dengan pemulihan aktivitas enzim.
Penghambatan kompetitif.Inhibitor mirip dengan substrat enzim dalam strukturnya dan bersaing dengan substrat untuk mendapatkan pusat aktif ( berada pada sisi aktif enzim), yang menyebabkan penurunan pengikatan substrat ke enzim dan gangguan katalisis. Inilah kekhasan penghambatan kompetitif - kemampuan untuk menambah atau mengurangi penghambatan dengan mengubah konsentrasi substrat.
Untuk jenis penghambatan kompetitif, persamaan berikut ini berlaku:
E + S ⇔ ES → E + P,
1. Interaksi kompetitif etanol Dan metanol untuk pusat aktif alkohol dehidrogenase.
2. Penghambatan asam malonat suksinat dehidrogenase, strukturnya mirip dengan struktur substrat enzim ini - asam suksinat (suksinat).

Suksinat + FAD ----------- Fumarat + FADN 2
3. Inhibitor kompetitif juga mencakup antimetabolit atau substrat semu, misalnya agen antibakteri sulfonamid, strukturnya mirip dengan P-asam aminobenzoat, komponen asam folat. Ketika diobati dengan sulfonamid, sel bakteri secara kompetitif mengganggu penggunaan sulfonamid P-asam aminobenzoat untuk sintesis asam folat, yang menyebabkan efek terapeutik.

Kesamaan struktur sulfonamid dan asam para-aminobenzoat, salah satu komponen vitamin B9

Pengaruh konsentrasi substrat yang berbeda terhadap laju reaksi yang dikatalisis oleh enzim 1 dan2(dengan adanya inhibitor): a) ketergantungan hiperbolikVdari [S], b) ketergantungan langsung pada koordinat terbalik 1/Vdari 1/[S] - Lineweaver-Burk.
Inhibitor kompetitif mengurangi laju reaksi kimia. Inhibitor kompetitif meningkatkan K m untuk substrat tertentu (mengurangi afinitas substrat terhadap enzim). Artinya dengan adanya inhibitor kompetitif diperlukan konsentrasi substrat yang tinggi untuk mencapai 1/2 V maks. Meningkatkan rasio konsentrasi substrat terhadap inhibitor mengurangi tingkat penghambatan. Pada konsentrasi substrat yang jauh lebih tinggi, penghambatan hilang sama sekali, karena pusat aktif semua molekul enzim akan berlokasi terutama di kompleks dengan substrat.
Penghambatan non-kompetitif.penghambattidak punya kesamaan struktural dengan substrat danmenempel di tempat selain situs aktif, dan di tempat lain molekul, bersamaan dengan substrat. Kompleks rangkap tiga terbentuk: substrat - enzim - inhibitor. Hal ini menyebabkan deformasi situs aktif dan aktivitas katalitik. Misalnya, asam hidrosianat (sianida) mengikat besi heme dari enzim rantai pernapasan dan menghambat respirasi sel.

Ketergantungan kinetik dari penghambatan non-kompetitif: ditandai dengan penurunan V max reaksi enzimatik dan penurunan afinitas substrat terhadap enzim, yaitu. meningkatkan Km.

Penghambatan nonkompetitif dalam koordinat invers ganda pada konsentrasi inhibitor berbeda (1 - [I]=0; 2 - [I]>0; 3 - [I]>[I]2).
Dengan penghambatan nonkompetitif, konstanta Michaelis tidak berubah, dan laju reaksi maksimum berkurang sebesar (1 + [ SAYA]/K Saya) sekali. Oleh karena itu, dalam koordinat timbal balik ganda, rangkaian garis lurus yang berhubungan dengan konsentrasi inhibitor yang berbeda berpotongan pada satu titik pada sumbu absis. Penghambatan ireversibel diamati dalam kasus pembentukan ikatan kovalen yang stabil antara molekul inhibitor dan enzim. Seringkali, pusat aktif enzim diubah. Akibatnya, enzim tidak dapat melakukan fungsi katalitik.
Inhibitor ireversibel termasuk ion logam berat, seperti merkuri (Hg 2+), perak (Ag +) dan arsenik (As 3+), yang dalam konsentrasi rendah memblokir gugus sulfhidril pada situs aktif. Dalam hal ini, substrat tidak dapat mengalami transformasi kimia (Gbr. 2-26). Dengan adanya reaktivator, fungsi enzimatik dipulihkan. Dalam konsentrasi tinggi, ion logam berat menyebabkan denaturasi molekul protein enzim, yaitu. menyebabkan inaktivasi total enzim.
Orenburg – 2010
1.1 Penghambatan reversibel
1.1.2 Penghambatan non-kompetitif
1.1.3 Penghambatan non-kompetitif
1.2 Penghambatan ireversibel
1.3 Penghambatan alosterik
2. Jenis baru penghambatan aktivitas enzimatik
3. Penggunaan inhibitor enzim
KESIMPULAN
Daftar literatur bekas
1. Penghambat enzim. Jenis penghambatan aktivitas enzim
Diketahui bahwa aktivitas enzim dapat dikurangi dengan relatif mudah melalui berbagai pengaruh. Penurunan laju reaksi enzimatik ini biasa disebut penghambatan aktivitas, atau penghambatan enzim.
Gambar 1. Skema aktivasi dan penghambatan kerja enzim (menurut Yu. B. Filippovich): a. – pusat alosterik enzim; K - pusat katalitik; c - pusat substrat
Enzim adalah protein; oleh karena itu, aktivitasnya dapat dikurangi atau dihilangkan seluruhnya melalui pengaruh yang menyebabkan denaturasi protein (pemanasan, paparan asam pekat, basa, garam logam berat dll.) Penekanan aktivitas enzim yang tidak spesifik ini, yang penting dalam mempelajari reaksi enzimatik, tidak menjadi perhatian khusus untuk mempelajari mekanismenya. Yang jauh lebih penting adalah studi tentang penghambatan dengan menggunakan zat yang secara khusus dan biasanya dalam jumlah kecil berinteraksi dengan enzim – penghambat enzim. Menguraikan mekanisme banyak proses biologis, seperti glikolisis, siklus Krebs, dan lainnya, menjadi mungkin hanya sebagai akibat dari penggunaan inhibitor spesifik berbagai enzim (N.E. Kucherenko, Yu.D. Babenyuk et al., 1988).
Beberapa penghambat enzim merupakan zat obat yang efektif bagi tubuh hewan dan manusia, sementara yang lain merupakan racun yang mematikan (V.P. Komov, V.N. Shvedova, 2004).
Inhibitor berinteraksi dengan pusat aktif molekul enzim, menonaktifkan gugus fungsi protein. Mereka dapat berinteraksi dengan logam yang merupakan bagian dari molekul enzim dan kompleks enzim-substrat, menonaktifkannya. Inhibitor konsentrasi tinggi menghancurkan struktur kuaterner, tersier dan sekunder dari molekul enzim, menyebabkan denaturasinya (A.I. Kononsky, 1992).
Baru-baru ini telah ditemukan antienzim (antienzim, atau antizim), yaitu protein yang bertindak sebagai penghambat enzim. Zat-zat tersebut termasuk, misalnya, inhibitor trypsin, yang ditemukan dalam kedelai, dan serum antitripsin. Antienzim ornithine decarboxylase baru-baru ini ditemukan di hati hewan. Antizim kemungkinan besar membentuk kompleks yang sulit dipisahkan dengan enzim yang sesuai, sehingga mematikannya reaksi kimia. Terkadang penghambatnya adalah komponen integral prekursor suatu enzim, atau merupakan bagian dari kompleks enzim yang kompleks. Namun, belum diklarifikasi apakah antienzim tersebut merupakan inhibitor sejati atau subunit pengatur.
Jika suatu inhibitor menyebabkan perubahan terus-menerus pada struktur tersier spasial molekul enzim atau modifikasi gugus fungsi enzim, maka jenis penghambatan ini disebut ireversibel. Namun, lebih sering terjadi penghambatan reversibel, yang dapat diukur menggunakan persamaan Michaelis-Menten. Penghambatan reversibel, pada gilirannya, dibagi menjadi kompetitif dan non-kompetitif
Dalam praktiknya, banyak inhibitor tidak menunjukkan sifat-sifat penghambatan murni kompetitif atau nonkompetitif murni. Cara lain untuk mengklasifikasikan inhibitor didasarkan pada sifat tempat pengikatannya. Beberapa di antaranya berikatan dengan enzim di tempat yang sama dengan substrat (di pusat katalitik), sementara yang lain berikatan pada jarak yang cukup jauh dari pusat aktif (di pusat alosterik) (R. Murray, D. Grenner et al., 1993).
1.1 Penghambatan reversibel
Ada tiga jenis penghambatan enzim yang dapat dibalik: kompetitif, non-kompetitif, dan non-kompetitif, bergantung pada apakah penghambatan reaksi enzimatik dapat diatasi atau tidak dengan meningkatkan konsentrasi substrat.
1.1.1 Penghambatan kompetitif
Inhibitor kompetitif bersaing dengan substrat untuk berikatan dengan situs aktif, namun tidak seperti substrat, inhibitor kompetitif terikat enzim tidak mengalami konversi enzimatik. Ciri khas penghambatan kompetitif adalah bahwa hal itu dapat dihilangkan atau dilemahkan hanya dengan meningkatkan konsentrasi substrat. Misalnya, jika pada konsentrasi substrat dan inhibitor kompetitif tertentu, aktivitas enzim dihambat sebesar 50%, maka kita dapat mengurangi derajat penghambatan dengan meningkatkan konsentrasi substrat.
Dalam struktur tiga dimensinya, inhibitor kompetitif biasanya menyerupai substrat enzim tertentu. Berkat kesamaan ini, inhibitor kompetitif berhasil “menipu” enzim dan menghubunginya. Penghambatan kompetitif dapat dipelajari secara kuantitatif berdasarkan teori Michaelis-Menten. Inhibitor kompetitif I hanya menempel secara reversibel pada enzim E, membentuk kompleks dengannya
Penghambatan kompetitif paling mudah dikenali secara eksperimental dengan menentukan pengaruh konsentrasi inhibitor terhadap ketergantungan laju reaksi awal pada konsentrasi substrat. Untuk memperjelas pertanyaan tentang jenis penghambatan enzim yang dapat dibalik - kompetitif atau non-kompetitif - yang terjadi, metode timbal balik ganda digunakan. Dari grafik yang dibuat dalam koordinat invers ganda, juga dimungkinkan untuk menentukan nilai konstanta disosiasi kompleks penghambat enzim (lihat Gambar 1) (A. Leninger, 1985)
Penghambatan kompetitif dapat disebabkan oleh zat yang mempunyai struktur serupa dengan substrat, namun sedikit berbeda dengan struktur substrat sebenarnya. Penghambatan ini didasarkan pada pengikatan inhibitor ke situs pengikatan substrat (aktif) (lihat Gambar 2).

Beras. 2. Prinsip umum penghambatan kompetitif (skema menurut V.L. Kretovich). E - enzim; S - substrat; P 1 dan P 2 - produk reaksi; saya - penghambat.
Contohnya adalah efek asam malonat pada reaksi yang dikatalisis oleh suksinat dehidrogenase dan berhubungan dengan konversi asam suksinat menjadi asam fumarat. Menambahkan asam malonat ke dalam campuran reaksi akan mengurangi atau menghentikan sepenuhnya reaksi enzimatik penghambat kompetitif suksinat dehidrogenase. Kemiripan asam malonat dengan asam suksinat cukup untuk membentuk kompleks dengan enzim, tetapi penguraian kompleks ini tidak terjadi. Ketika konsentrasi asam suksinat meningkat, ia menggantikan asam malonat dari kompleks, akibatnya aktivitas suksinat dehidrogenase dipulihkan.

Beras. 3. Penghambatan kompetitif reaksi konversi asam suksinat menjadi asam fumarat di bawah pengaruh asam malonat.
Struktur substrat (suksinat) dan inhibitor (malonat) masih agak berbeda. Oleh karena itu, mereka bersaing untuk mengikat situs aktif, dan tingkat penghambatan akan ditentukan oleh rasio konsentrasi malonat dan suksinat, dan bukan oleh konsentrasi absolut inhibitor. Dengan demikian, inhibitor dapat berikatan secara reversibel dengan enzim, membentuk kompleks enzim-inhibitor. Jenis penghambatan ini kadang-kadang disebut penghambatan antagonisme metabolik (lihat Gambar 3).
Secara umum, reaksi antara inhibitor dan enzim dapat direpresentasikan dengan persamaan berikut:

Kompleks yang dihasilkan, disebut kompleks enzim-inhibitor EI, tidak seperti kompleks enzim-substrat ES, tidak terurai membentuk produk reaksi.
Banyak obat yang menghambat enzim manusia dan hewan secara kompetitif. Misalnya obat sulfonamida yang digunakan untuk mengobati beberapa penyakit menular yang disebabkan oleh bakteri. Ternyata obat ini secara struktural mirip dengan asam para-aminobenzoat, yang digunakan sel bakteri untuk mensintesis asam folat, yang merupakan bagian integral dari enzim bakteri. Karena kesamaan struktural ini, sulfonamida menghambat kerja enzim dengan menggantikan asam para-aminobenzoat dari kompleks dengan enzim yang mensintesis asam folat, yang menyebabkan penghambatan pertumbuhan bakteri.

Struktur peptidoglikan dinding sel bakteri termasuk D-alanin, yang tidak terdapat pada tubuh hewan dan manusia. Untuk mensintesis dinding sel, bakteri menggunakan enzim alanin racemase untuk mengubah L-alanin hewan menjadi bentuk D. Alanine racemase merupakan ciri khas bakteri dan tidak ditemukan pada mamalia. Oleh karena itu, ini merupakan target penghambatan yang baik obat. Substitusi salah satu proton gugus metil dengan fluor menghasilkan fluoroalanine, yang berikatan dengan alanine racemase, yang menyebabkan penghambatannya.