Расчеты по химическим уравнениям. с. Чермен Пригородного района РСО-Алания
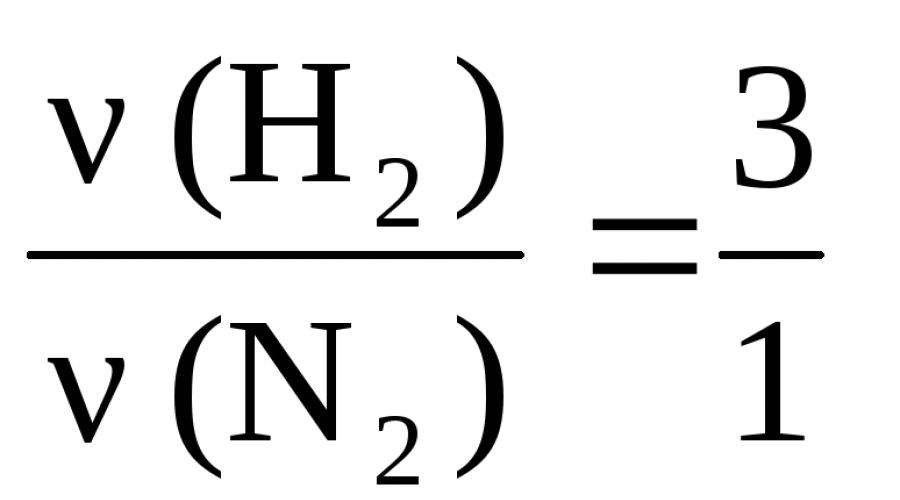
Читайте также
С помощью стехиометрических коэффициентов схема химической реакции переходит в ее уравнение, которое в явном виде отражает закон сохранения количества атомов каждого вида при переходе от исходных веществ (реагентов) к продуктам реакции.
Стехиометрические коэффициенты позволяют установить связь между количествами участвующих в реакции веществ на основе следующего правила:
коэффициенты в химическом уравнении задают молярные пропорции (отношения), в которых вступают в реакцию исходные вещества (реагенты) и образуются продукты реакции.
Рассмотрим в качестве примера реакцию синтеза аммиака:
3H 2 + N 2 = 2NH 3 ,
для которой согласно приведенному правилу можно записать
где индексы «пр.» и «обр.» соответствуют количествам прореагировавших и образовавшихся веществ. Последнее соотношение можно представить в ином виде:
а) для веществ H 2 и N 2:
или в другой форме
 ;
;
б) для веществ H 2 и NH 3: или
или ;
;
в) для веществ N 2 и NH 3: или
или .
.
Легко видеть, что все пропорции можно объединить и записать в виде:
 =
= .
.
Последнее равенство является основным расчетным уравнением , связывающим количества прореагировавших веществ и образовавшихся продуктов реакции. При необходимости в это уравнение можно из условия задачи ввести массы и объемы участников реакции, используя обычные соотношения.
Например, для реакции
4FeS 2 (т) + 11О 2 = 2Fe 2 O 3 (т) + 8SO 2 (г)
основное расчетное уравнение имеет вид:
и если в него ввести обычно задаваемые в задачах для твердых веществ их массы, а для газов – объемы, то оно примет следующую форму:
Методика вычислений с использованием основного расчетного уравнения химической реакции включает в себя несколько общих моментов:
1) Прежде всего определяют опорное вещество, по количеству которого проводят весь последующий расчет. В условии задачи для него задана или масса, или объем, или концентрация, которые, в свою очередь, позволяют вычислить число молей опорного вещества. Как правило, это не составляет большого труда, а исключение относится к так называемым задачам на избыток и недостаток, когдаопорное вещество нужно выбрать издвух исходных. Дело в том, что при приготовлении реакционной смеси исходные вещества можно смешивать в любых пропорциях, но реагировать друг с другом они будут всегда в строго определенных пропорциях, которые устанавливают для них стехиометрические коэффициенты в уравнении химической реакции. В этих условиях вполне возможна ситуация, когда одно из исходных веществ прореагирует полностью, а часть другого останется не прореагировавшей и тогда говорят, что первое вещество взято в недостатке по отношению ко второму и, наоборот, второе вещество находится в избытке по отношению к первому. В данном случае в качестве опорного вещества следует выбрать исходное вещество, взятое в недостатке, поскольку именно его количество будет определять как окончание реакции, так и количества образующихся продуктов.
Как определить опорное вещество, если в задаче указаны данные (массы, объемы и др.) для обоих исходных веществ? Пусть в реакцию вступают два вещества А и В
аА + вВ → продукты реакции,
а исходные количества этих веществ 0 (А) и 0 (В) можно вычислить из условия задачи.
Для
ответа на поставленный вопрос нужно
сравнить два числа
 ,
где возможны три варианта:
,
где возможны три варианта:
I
вар.
 ,
тогда исходная реакционная смесь
называется стехиометрической и в
качестве опорного вещества может быть
выбрано любое из них – А или В;
,
тогда исходная реакционная смесь
называется стехиометрической и в
качестве опорного вещества может быть
выбрано любое из них – А или В;
II
вар.
 ,
тогда вещество А взято в избытке и
опорным будет вещество В;
,
тогда вещество А взято в избытке и
опорным будет вещество В;
III
вар.
 ,
тогда вещество В будет в избытке и
опорным является вещество А.
,
тогда вещество В будет в избытке и
опорным является вещество А.
Окончание необратимых химических реакций в первом варианте происходит в момент одновременного исчезновения обоих исходных веществ, а в двух других – в момент исчезновения вещества, взятого в недостатке, причем в конечной смеси веществ, наряду с продуктами реакции, будет присутствовать не прореагировавший остаток вещества, взятого в избытке.
2) Из основного расчетного уравнения вытекает простое правило определения числа молей вступивших в реакцию исходных веществ и образовавшихся продуктов по числу молей опорного вещества:
для определения числа молей прореагировавшего или образовавшегося в реакции вещества необходимо число молей опорного вещества разделить на его стехиометрический коэффициент и этот результат умножить на стехиометрический коэффициент определяемого вещества.
Для реакции 2Al + 6HCl = 2AlCl 3 + H 2 ,
где опорным веществом, например, является алюминий можно записать:



Определив количества интересующих нас веществ, легко рассчитать их массы, объемы и концентрации, то есть те характеристики участников химической реакции, которые фигурируют в условии задачи.
Таким образом, общая схема расчета по уравнению химической реакции может быть представлена в виде:
Необратимая реакция.
Пусть
 и
и начальные количества реагентов А и В и
начальные количества реагентов А и В и ,
т.е. вещество А взято в избытке, тогда
,
т.е. вещество А взято в избытке, тогда
a A + в В = с С + d D
|
(избыток) |
(недостаток) | |||||
|
окончание реакции: |
|
|
|
|||
Обратимая реакция.
В этом случае реакция заканчивается установлением химического равновесия и равновесная смесь содержит как продукты реакции, так и остаток исходных веществ. Пусть к моменту установления равновесия образовалось, например, х моль продукта С – это опорное вещество, то
a A + в В с С + d D
|
Начало реакции: |
|
| ||
|
Равновесие: |
|
|
|
|
Пример 1. Раствор, содержащий 20,0 г гидроксида натрия поглотил 6,72 л углекислого газа (н. у.). Определите продукты реакции и их количества.
При поглощении раствором щелочи кислотных оксидов (СО 2 ,SO 2 ,P 2 O 5 и др.) или водородных соединений (H 2 Sи др.), которым соответствуют многоосновные кислоты, на первом этапе при избытке щелочи всегда образуются средние соли, которые на втором этапе при наличии избытка поглощаемого реагента частично или полностью переходят в кислые соли:
СО 2 (газ) + 2 NaOH = Na 2 CO 3 + Н 2 О
Остаток углекислого газа реагирует с карбонатом натрия:
Na 2 CO 3 + СО 2 (газ) + Н 2 О = 2 NaHСО 3
|
окончание реакции: |
|
|
Итак, в растворе присутствует смесь солей: 0,1 моль NaHCO 3 и 0,2 моль Na 2 CO 3 .
Пример 2. В стакан с 200 мл раствора фосфорной кислоты с молярной концентрацией 0,5 моль/л внесли 6 г гидроксида натрия. Определите состав раствора после окончания реакции.
При нейтрализации щелочью (NaOH, KOH, NH 3 и др.) многоосновных кислот происходит последовательное замещение атомов водорода на металл или аммонийную группу и состав продуктов реакции зависит от соотношения количеств реагентов. В нашем случае, если – образуетсяNaH 2 PO 4 ; если 1: 2 , то Na 2 HPO 4 и если 1: 3 , то Na 3 PO 4 . В промежуточных вариантах возникает смесь солей.
Найдем
исходные количества реагентов:
; ,
– имеет место промежуточный вариант
между 1: 1 и 1: 2 , поэтому реакция идет в
два этапа:
,
– имеет место промежуточный вариант
между 1: 1 и 1: 2 , поэтому реакция идет в
два этапа:
H 3 PO 4 + NaOH = NaH 2 PO 4 + H 2 O
NaH 2 PO 4 + NaOH = Na 2 HPO 4 + H 2 O
Итак, в растворе после реакции присутствует смесь солей – по 0,05 моль NaH 2 PO 4 и Na 2 HPO 4 .
Успех в проведении расчетов по цепочкам химических уравнений в случае, когда продукт одной реакции является исходным веществом для другой, зависит от правильного выбора последовательности переходов от одного уравнения к другому. Выбрав согласно условию задачи опорное вещество, стрелками удобно указать последовательность расчета, помня при этом, что вещество, полученное в предыдущей реакции, в том же количестве используется в последующей если, естественно, в ходе всего многостадийного процесса нет потерь и выход каждой реакции 100 %.
Пример 3. Сколько литров хлора и водорода (н.у.) необходимо для получения хлороводорода, способного нейтрализовать раствор щелочи, образующийся при растворении в воде 13,7 г бария.
Составим уравнения всех реакций и стрелками укажем последовательность расчета:

Опорное вещество барий и его количество
(Ва) =
 .
.
Цепочка расчетов:
уравнение (I) - (Ba(OH) 2 /
I) = =>
=>
уравнение (II) - (HCl / II)=> уравнение (III) –
(Cl 2) =(H 2) = ,
,
тогда V(H 2) = V(Cl 2) = 0,1 моль· 22,4 л/моль = 2,24 л.
При решении задач на смеси веществ необходимо прежде всего для каждого компонента смеси отдельно записать все химические реакции, в которых он может участвовать в соответствии с условием задачи. В качестве опорных веществ обычно выбирают вещества исходной смеси и их количества (число молей) обозначают как неизвестные – x, y, z, …., а затем составляют уравнения материального баланса по количеству, массе или объему (для газов) участников химических реакций, где два последних необходимо выразить через неизвестные. Число балансовых уравнений должно быть равно числу неизвестных. На последнем этапе решается полученная система алгебраических уравнений.
Пример 4. При сгорании 13,44 л (н. у.) смеси водорода, метана и угарного газа образовалось 8,96 л углекислого газа и 14,4 г воды. Определить количества газов в смеси.
Уравнения реакций:
2H 2 + O 2 = 2H 2 O (I)
CH 4 + 2O 2 = CO 2 + 2H 2 O (II)
2CO + O 2 = 2CO 2 (III)
Опорные вещества – CH 4 , H 2 и CO; обозначим их количества
ν(H 2) = x; ν(СH 4) = y; ν(CO) = z.
Составим три балансовых уравнения по числу неизвестных:
а) баланс по объему смеси:
V (H 2) + V(CH 4) + V(CO) = 13,44 л, введем в него неизвестные:
xV m + yV m + zV m = 13,44 или x + y + z = 0,6
моль;
0,6
моль;
б) баланс по количеству CO 2:
ν(CO 2 / II) + ν(CO 2 / III) = ν общ. (CO 2), но
 ;
;
ν(CO 2 /
II) = ν(CH 4)
= y; ν(CO 2 /
III) =  z,
тогда
y + z = 0,4.
z,
тогда
y + z = 0,4.
в) баланс по количеству H 2 O:
ν(H 2 O/ I) + ν(H 2 O/ II) = ν общ. (H 2 O), но
 ,
,
 ;
; ,
,
тогда x + 2y = 0,8.
Итак, получаем систему уравнений вида
 ,
,
которая легко решается устно
x = 0,2 моль; y = 0,3 моль; z = 0,1 моль.
Развернутый план-конспект урока «Расчеты по химическим уравнениям».
Учебник: О.С. Габриелян.
Класс: 8
Тема урока: Расчеты по химическим уравнениям.
Тип урока: комбинированный.
Образовательные задачи: познакомить с расчетами по химическим уравнениям; сформировать у учащихся знание о расчетах по химическим уравнениям; начать формировать умения по составлению химических уравнений и расчетам по уравнениям.
Воспитательные задачи: продолжить формирование естественнонаучного мировоззрения, представления о единичном и целом.
Развивающие задачи: продолжить формирования умения наблюдать, анализировать, объяснять, делать выводы.
Методы обучения: словесные (объяснение и рассказ учителя), словесно – наглядные(объяснение с использованием записей на классной доске).
Оборудование: классная доска, таблица Д. И. Менделеева.
Ход урока:
1.Организационный момент (2-5мин.)
Здравствуйте ребята присаживайтесь. Сегодня на уроке мы с вами должны будем научиться проводить расчеты по химическим уравнениям.
2. Контроль знаний и умений (10 – 15 мин.)
На предыдущих занятиях мы с вами проходили уравнения химических реакций, давайте вспомним, что такое химическое уравнение? (Химическим уравнением называют условную запись химической реакции с помощью химических формул и математических знаков).
На основе какого закона пишут химические реакции? (Закон сохранения массы веществ).
Как он звучит? (Масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в результате ее).
3. Объяснение нового материала (20 – 30 мин.)
По химическому уравнению можно определить, какие вещества вступили в реакцию, и какие образовались, а также по химическому уравнению можно рассчитать массу, объем и количество реагирующих веществ.
Для расчетов очень важно выбрать соответствующие друг другу единицы измерения массы, объема и количества вещества. Давайте откроем учебники на странице 146 и найдем таблицу №7. Рассмотрим по этой таблице соотношение некоторых единиц физико – химических величин.
Для того чтобы решать расчетные задачи по химии, можно пользоваться алгоритмом. Алгоритм решения задач дан в учебнике на странице 147.
Пользуясь алгоритмом решения задач, давайте решим следующие задачу:
Задача: Рассчитайте объем водорода (н.у.), который потребуется для взаимодействия с 230 кг оксида железа (ІІІ). Вычислите количество вещества воды, которое при этом образуется.
Дано: Решение:
m(Fe 2 O 3)=230кг 1. Запишем уравнение химической реакции:
V(H 2) - ?
n(H 2 O) - ? 2. Запишем известные и неизвестные числовые значения над формулами веществ в уравнении.
Так как масса дана в килограммах, то объем находим в кубических метрах, а количество вещества – в киломолях. И тогда:
230кг х м 3 y кмоль
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
где х – объем водорода V(H 2), y – количество вещества воды n(H 2 O).
3. а)Найдем заданную химическим уравнением массу 1кмоль Fe 2 O 3 и запишем полученное значение под его формулой:
Мr(Fe 2 O 3) = 56 * 2 + 16 * 3 = 160,
М(Fe 2 O 3) = 160 кг/кмоль.
б) Найдем заданный уравнением объем 3 кмоль водорода V = Vm*n, запишем под формулой водорода найденное значение: V(3H 2) = 22,4 м 3 /кмоль * 3 кмоль = 67,2 м 3 .
в) Под формулой воды укажем ее количество, заданное уравнением, - 3 кмоль.
Уравнение принимает вид
230кг х м 3 y кмоль
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
160кг 67,2 м 3 3 кмоль
4. Составим и решим пропорции:
а) 230 = х, х = 230*67,2 = 201,6 (м 3) – объем водорода V(H 2)
б) 230 = y , y = 230*3 = 9 (кмоль) – количество вещества воды n(H 2 O).
4.Первичное закрепление знаний (10 – 12 мин.)
Решите задачи (если можно, то несколькими способами):
Задача 1. В реакцию с кислородом вступает 0,1 моль цинка. Какое количество вещества кислорода потребуется? Какое количество вещества оксида цинка образуется?
Задача 2. Цинк количеством вещества 0,1 моль взаимодействует с кислородом. Определите массу кислорода, вступающего в реакцию, а также массу образующегося оксида цинка.
Задача 3. Алюминий массой 6,3 г вступает в реакцию с кислородом. Определите массы кислорода и образующегося оксида железа, если алюминий содержит 20% примесей.
Задача 4. Какой объем водорода (н.у.) выделится при взаимодействии 2,7 г 25% - й соляной кислоты с необходимым по реакции количеством вещества алюминия? Каково это количество вещества?
Задача 5. Какой объем углекислого газа выделится при сгорании 60 кг угля?
Задача 6. Сколько молей оксида кальция образуется при сжигании в кислороде 8 г кальция, содержащего 30% примесей?
5. Итог урока (1 -3 мин.)
Сегодня на уроке мы с вами еще раз вспомнили написание химических уравнений и научились проводить расчеты с помощью химических уравнений.
6. Домашнее задание (1 – 4 мин.)
§28, задание в рабочих тетрадях.
Какая масса оксида железа (ІІІ) образуется при сжигании на воздухе 0,6 моль железа?
Рассчитайте массу сульфида алюминия, образующегося при сплавлении с серой 5,4 г алюминиевой пудры. Сколько граммов сульфида железа (ІІ) образуется при сплавлении с серой 11,2 г порошка железа?
Определите массу магния, необходимого для получения 19 г хлорида магния (например сжигая магний в хлоре).
Сколько литров хлороводорода образуется при взаимодействии хлора с 5,5 л водорода?
Какой объем водорода может вступить в реакцию со 150 л кислорода?
Какой объем углекислого газа образуется при сжигании 8 л метана СН 4 ?
Какой объем углекислого газа образуется при сжигании 480 г угля?
Какой объем кислорода выделится при разложении электрическим током 100г воды?
Какой объем азота образуется при взрыве 1 г йодистого азота:
2NJ 3 = N 2 + 3J 2
Сколько граммов оксида серы (ІV) образуется при сжигании 12,8 серы?
Какая масса оксида магния образовались при сжигании в кислороде 6 г магниевой стружки?
Сколько граммов воды образуется при сжигании в кислороде 9 г водорода?
Сколько граммов алюминия надо взять для получения 30,6 г оксида алюминия?
Сколько граммов лития необходимо сжечь в кислороде для получения 15 г оксида лития?
Сколько граммов хлорида натрия образуется при сжигании в хлоре 11,5г натрия?
Сколько молей железа необходимо взять для получения 32,5 г хлорида железа (ІІІ)?
Сколько граммов алюминия необходимо взять для получения 80,1 г хлорида алюминия?
Сколько молей оксида кальция образуется при сжигании в кислороде 8 г кальция?
Сколько граммов хлорида алюминия образуется при сгорании в хлоре 10,8 г алюминиевой фольги?
Стехиометрия - количественные соотношения между вступающими в реакцию веществами.
Если реагенты вступают в химическое взаимодействие в строго определенных количествах, а в результате реакции образуются вещества, количество которых можно расчитать, то такие реакции называются стехиометрическими .
Законы стехиометрии:
Коэффициенты в химических уравнениях перед формулами химических соединений называются стехиометрическими .
Все расчёты по химическим уравнениям основаны на использовании стехиометрических коэффициентов и связаны с нахождением количеств вещества (чисел молей).
Количество вещества в уравнении реакции (число молей) = коэффициенту перед соответствующей молекулой.
N A =6,02×10 23 моль -1 .
η - отношение реальной массы продукта m p к теоретически возможной m т, выраженное в долях единицы или в процентах.
Если в условии выход продуктов реакции не указан, то в расчетах его принимают равным 100% (количественный выход).
Схема расчёта по уравнениям химических реакций:
- Составить уравнение химической реакции.
- Над химическими формулами веществ написать известные и неизвестные величины с единицами измерения.
- Под химическими формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
- Составить и решить пропорцию.
Пример. Вычислить массу и количество вещества оксида магния, образовавшегося при полном сгорании 24 г магния.
|
Дано: m (Mg ) = 24 г Найти: ν ( MgO ) m ( MgO ) |
Решение: 1. Составим уравнение химической реакции: 2Mg + O 2 = 2MgO. 2. Под формулами веществ укажем количество вещества (число молей), которое соответствует стехиометрическим коэффициентам: 2Mg + O 2 = 2MgO 2 моль 2 моль 3. Определим молярную массу магния: Относительная атомная масса магния Ar (Mg) = 24. Т.к. значение молярной массы равно относительной атомной или молекулярной массе, то M (Mg) = 24 г/моль. 4. По массе вещества, заданной в условии, вычислим количество вещества:
5. Над химической формулой оксида магния MgO , масса которого неизвестна, ставим x моль , над формулой магния Mg пишем его молярную массу: 1 моль x моль 2Mg + O 2 = 2MgO 2 моль 2 моль
По правилам решения пропорции:
Количество оксида магния ν (MgO) = 1 моль. 7. Вычислим молярную массу оксида магния: М (Mg) =24 г/моль, М (О) =16 г/моль. M (MgO) = 24 + 16 = 40 г/моль. Рассчитываем массу оксида магния: m (MgO) = ν (MgO) ×M (MgO) = 1 моль×40 г/моль = 40 г. Ответ: ν (MgO) = 1 моль; m (MgO) = 40 г. |
Задача 121.
Смешано 7,3г НСI с 4,0г NH
3 . Сколько граммов NH
4 С1 образуется? Найти массу оставшегося после реакции газа.
Решение:
Уравнение реакции имеет вид:
NH 3 + HCl = NH 4 Cl
Молекулярные массы HCl, NH 3 и NH 4 Cl соответственно равны 36,453, 17 и 53,453. Следовательно, их мольные массы составляют 36,453; 17; 53,453г/моль. Согласно уравнению реакции 1 моль HCl реагирует с 1 моль NH 3 , образуя 1 моль NH4Cl. Находим, какое вещество взято в недостатке:
В недостатке взято 0,2 моля HCl, значит, расчёт массы, образовавшейся соли NH 4 Cl, производим по количеству соляной кислоты:
m(NH 4 Cl) = 0,2 . 53,453 = 10,69г.
Затем рассчитаем массу NH3, вступившего в реакцию с HCl:
m(NH 3) = 0,2. 17 = 3,4г.
Ответ: 10,69г NH 4 Cl; 3,4г NH 3 .
Задача 122.
Какой объем воздуха потребуется для сжигания 1м 3 газа, имеющего следующий состав по объему: 50% Н 2 , 35% СН 4 , 8% СО, 2% С 2 Н 4 и 5% негорючих примесей. Объемное содержание кислорода в воздухе равно 21%.
Решение:
Рассчитаем объём кислорода, необходимый для сжигания газов.
а) Уравнение реакции сгорания водорода:
2Н 2 + О 2 = 2Н 2 О
Находим объём водорода, содержащегося в 1м 3 газа из пропорции:

Согласно уравнению реакции на сжигание 2 молей Н 2 расходуется 1 моль О 2 т. е. на сжигание 44,8л водорода требуется 22,4л кислорода.

б) Уравнение реакции сгорания метана:
СН 4 + О 2 = СО 2 + 2Н 2 О
Находим объём метана, содержащегося в 1м 3 газа из пропорции:

Согласно уравнению реакции на сжигание 1 моль СН 4 расходуется 2 моля О 2 т. е. на сжигание 22,4л метана требуется 44,8л кислорода.
Находим объём расходуемого кислорода из пропорции:

в) Уравнение реакции горения угарного газа:
2CO + O 2 = 2CO 2
Находим объём угарного газа, содержащегося в 1м 3 газа из пропорции:

Согласно уравнению реакции на сжигание 2 молей СО расходуется 1 моль О 2 т. е. на сжигание 44,8л угарного газа требуется 22,4л кислорода.
Находим объём расходуемого кислорода из пропорции:

г) Уравнение реакции горения этилена:
C 2 H 4 + 3O 2 = 2CO 2 + 2H 2 O
Согласно уравнению реакции на сжигание 1 моль С 2 Н 4 расходуется 3 моль О 2 , т.е. затрачивается в три раз больший объём кислорода, чем этилена.

Кислорода для сжигания этилена требуется в три раза больше по объёму, чем этилена, а именно 60л (20 . 3 = 60).
Теперь находим общий объём кислорода, затраченный на сжигание 1м 3 газа:
V(O 2) = 250 + 700 + 40 + 60 = 1050 л.
Рассчитаем объём воздуха, содержащий 1050 л кислорода из пропорции

Ответ:
5м 3
Задача 123.
При пропускании водяного пара над раскаленным углем получается водяной газ, состоящий из равных объемов СО и Н 2 . Какой объем водяного газа (условия нормальные) может быть получен из 3,0 кг угля?
Решение:
C(к) + H 2 О(г) = СО(г) + Н 2 (г)
Согласно уравнению реакции из одного моля угля и одного моля воды образуется «водяной газ», состоящий из одного моля угарного газа и одного моля водорода. Мольная масса углерода равна 12 кг/кмоль; 1 кмолоь «водяного газа» занимает объём 44,8м 3 .
Рассчитаем объём водяного газа, образуемого из 3кг угля из пропорции:

Ответ: 11,2м 3 .
Задача 124.
Карбонат кальция разлагается при нагревании на СаО и СО 2 . Какая масса природного известняка, содержащего 90% (масс.) СаСО 3 , потребуется для получения 7,0т негашеной извести?
Решение:
Уравнение протекающей реакции:
СаСO 3 CaO + CO 2
Молекулярные массы СаСО 3 и СаО соответственно равны 100 и 56, следовательно, их мольные массы составляют 100 и 56г/моль. Согласно уравнению реакции 1 моль СаСО 3 образует 1 моль СаО. Находим теоретический выход негашёной извести из пропорции:

Находим массу природного известняка из пропорции:

Ответ: 13,9т.
Задача 125.
К раствору, содержащему 6,8г АIСl 3 , прилили раствор, содержащий 5,0г КОН. Найти массу образовавшегося осадка.
Решение:
Уравнение протекающей реакции:
АIСl 3 + 3КОН = Al(OH) 3 ↓ + 3H 2 O
Мольные массы АlCl 3 , KOH и Al(OH)3 соответственно равны 133,34; 56 и 78 г/моль. Рассчитаем количество реагирующих веществ по формуле:
Где n
Отсюда

Согласно уравнению реакции 1 моль AlCl 3 реагирует с 3 моль КОН с образованием 1 моль Al(OH) 3 , т.е. КОН должно 0,15 моль (0,05 . 3 = 0,15), чем взято по условию задачи (0,09 моль). Таким образом, КОН взят в недостатке, поэтому расчёт массы Al(OH) 3 проводим по КОН, получим:
![]()
Ответ: 2,3г
Задача 126.
Через раствор, содержащий 7,4г гидроксида кальция, пропустили 3,36л диоксида углерода, взятого при нормальных условиях. Найти массу вещества, образовавшегося в результате реакции.
Решение:
Уравнение реакции имеет вид:
Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O
Молекулярные массы Са(ОН)2 и СаСО 3 соответственно равны 74 и 100, следовательно, их мольные массы составляют 74 и 100г/моль. Согласно уравнению реакции из 1 моль Са(ОН) 2 и 1 моль СО 2 образуется 1 моль СаСО 3 . Рассчитаем количество реагирующих веществ по формуле
Где n - количество вещества, моль; m(B) – масса вещества, г; M(B) – мольная масса, г/моль.

Следовательно, СО 2 взят в избытке и поэтому расчёт массы образовавшегося СаСО 3 будем проводить по Са(ОН) 2 .
m(CaCO 3) = n(CaCO 3) . M(CaCO 3) = 0,1 . 100 = 10г.
Ответ: 10г
3Сu + 8HNO 3 = 3Cu(NO 3) 2 + 2NO + 4H 2 O
Мольные массы Cu и Cu(NO 3) 2 соответственно равны 63,55 и 187,55г/моль. Согласно уравнению реакции из 3 моль Cu образуется 3 моль Cu(NO 3) 2 . Рассчитаем массу Cu(NO 3) 2 , образующуюся при растворении 10г меди в азотной кислоте:

Находим мольную массу кристаллогидрата нитрата меди:
M[(Cu(NO 3) 2) . 3H2O] = 187,55 + (3 . 18) = 214,55г/моль.
Рассчитаем массу образовавшегося кристаллогидрата меди:

Ответ : 38г
Задача 128.
При обработке раствором гидроксида натрия 3,90г смеси алюминия с его оксидом выделялось 840 мл газа, измеренного при нормальных условиях. Определить процентный состав (по массе) исходной смеси.
Решение:
Уравнения протекающих реакций:

Следовательно, водород образуется при растворении алюминия в растворе щёлочи Согласно уравнению реакции из 2 моль Al (2 . 27 = 54г) образуется 3 моль Н 2 или 67,2л (3 . 22,4 = 67,2). Рассчитаем массу алюминия в смеси из пропорции:

Теперь находим процентное содержание алюминия в смеси по формуле:
![]()
Где(B) - массовая доля вещества (В) в процентах, %; m(B) - масса вещества (В) в смеси, г; m(смеси) - масса смеси веществ, г.
![]()
Ответ: 17,3%.
Задача 129.
5,10г порошка частично окисленного магния обработали соляной кислотой. При этом выделилось 3,74л Н 2 , измеренного при нормальных условиях. Сколько процентов магния (по массе) содержалось в образце?
Решение:
Уравнение протекающей реакции:
Mg + 2HCl = MgCl 2 + H 2
Мольная масса Mg равна 24,312г/моль, мольный объём газа равен 22,4л/моль. Согласно уравнению реакции 1 моль магния выделяет 1 моль водорода. Рассчитаем массу магния, которая растворилась в кислоте из пропорции:

Процентный состав магния в образце определяем из пропорции:

Урок посвящен продолжению изучения темы «Уравнение химической реакции». В уроке рассматриваются простейшие расчеты по уравнению химической реакции, связанные с соотношением количеств веществ, участвующих в реакции.
Тема: Первоначальные химические представления
Урок: Уравнение химической реакции
1. Соотношение количеств веществ, участвующих в реакции
Коэффициенты в уравнении реакции показывают не только число молекул каждого вещества, но и соотношение количеств веществ, участвующих в реакции. Так, по уравнению реакции: 2H2 + O2 = 2H2O – можно утверждать, что для образования определенного количества воды (например, 2 моль) необходимо столько же моль простого вещества водорода (2 моль) и в два раза меньше моль простого вещества кислорода (1 моль). Приведем примеры подобных расчетов.
2. Задача 1
ЗАДАЧА 1. Определим количество вещества кислорода, образующегося в результате разложения 4 моль воды.
АЛГОРИТМ решения задачи:
1. Составить уравнение реакции
2. Составить пропорцию, определив количества веществ по уравнению реакции и по условию задачи (обозначить неизвестное количество вещества за х моль).
3. Составить уравнение (из пропорции).
4. Решить уравнение, найти х.
Рис. 1. Оформление краткого условия и решения задачи 1
3. Задача 2 ЗАДАЧА 2. Какое количество кислорода потребуется для полного сжигания 3 моль меди? Воспользуемся алгоритмом решения задач с использованием уравнения химической реакции.

Рис. 2. Оформление краткого условия и решения задачи 2.
Внимательно изучите алгоритмы и запишите в тетрадь, решите самостоятельно предложенные задачи
I . Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2 =2Al2 O3 ).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода
(4Na+O2
=2Na2
O).
Алгоритм №1
Вычисление количества вещества по известному количеству вещества, участвующего в реакции.
Пример. Вычислите количество вещества кислорода, выделившегося в результате разложения воды количеством вещества 6 моль.



II. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2
=SO2
).
2. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2
=2LiCl).
Алгоритм №2
Вычисление массы вещества по известному количеству другого вещества, участвующего в реакции.
Пример: Вычислите массу алюминия, необходимого для получения оксида алюминия количеством вещества 8 моль.



III. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2S).
2. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + H2
= Cu + H2
O).
Внимательно изучите алгоритм и запишите в тетрадь
Алгоритм №3
Вычисление количества вещества по известной массе другого вещества, участвующего в реакции.
Пример. Вычислите количество вещества оксида меди (I), если в реакцию с кислородом вступает медь массой 19,2г.



Внимательно изучите алгоритм и запишите в тетрадь
IV. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу кислорода, необходимую для реакции с железом массой 112 г
(3Fe + 4O2
=Fe3
O4
).
Алгоритм №4
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Пример. Вычислите массу кислорода, необходимую для сгорания фосфора, массой 0,31г.



ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2 =2Al2 O3 ).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2 =2Na2 O).
3. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2 =SO2 ).
4. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2 =2LiCl).
5. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2 S).
6. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + H2
= Cu + H2
O).
ТРЕНАЖЁРЫ
Тренажёр №1 - Анализ уравнения химической реакции
Тренажёр №6 - Стехиометрические расчёты
 моль
моль моль
моль


 моль
моль моль
моль







