ক্লোরিন রাসায়নিক বৈশিষ্ট্য। ক্লোরিন প্রাপ্ত ক্লোরিন পদ্ধতি। জল এবং জলীয় ক্ষার সমাধান মধ্যে অসম্পূর্ণতা ক্লোরিন
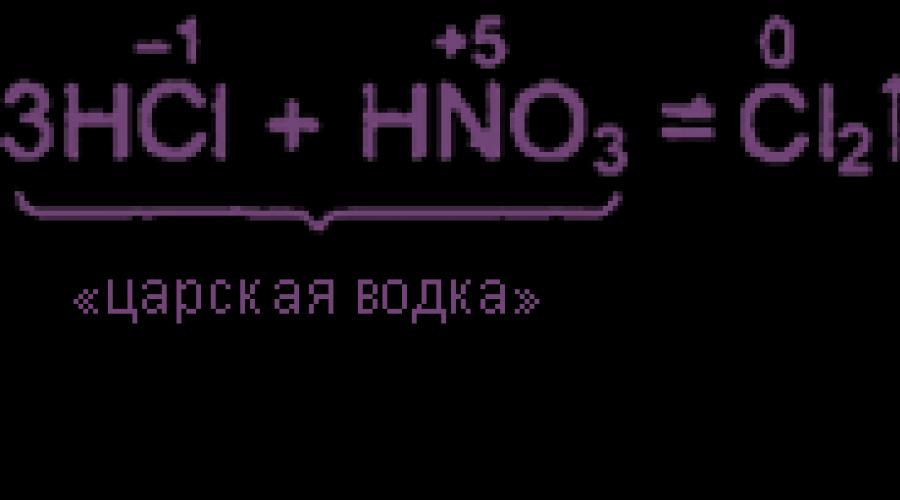
সংজ্ঞা
ক্লোরিন - রাসায়নিক উপাদান VII গ্রুপ 3 রাসায়নিক উপাদানগুলির পর্যায়ক্রমিক সিস্টেম D.I. Mendeleeva। অ ধাতু।
উপাদান বোঝায় - পি-পরিবার। হ্যালোজেন। সিরিয়াল নম্বর - 17. বাহ্যিক ইলেকট্রনিক স্তরের কাঠামো 3S 2 3 P 5। আপেক্ষিক পারমাণবিক ভর - 35.5 AEM। ক্লোরিন অণু ডাবল - সিএল 2।
রাসায়নিক বৈশিষ্ট্য ক্লোরিন
ক্লোরিন সহজ ধাতু সঙ্গে প্রতিক্রিয়া:
CL 2 + 2SB \u003d 2SBCL 3 (টি);
CL 2 + 2FE \u003d 2FECL 3;
CL 2 + 2NA \u003d 2NACL।
ক্লোরিন সহজ অ ধাতু পদার্থ সঙ্গে মিথস্ক্রিয়া। সুতরাং, ফসফরাস এবং সালফার সাথে ইন্টারঅ্যাক্ট করার সময়, উপযুক্ত ক্লোরাইডগুলি তৈরি করা হয়, ফ্লোরাইডের সাথে - ফ্লোরাইডগুলির সাথে হাইড্রোজেন - ক্লোরাইড হাইড্রোজেন, অক্সিজেন - অক্সাইডগুলি ইত্যাদি।:
5CL 2 + 2P \u003d 2HCL 5;
CL 2 + 2S \u003d SCL 2;
CL 2 + H 2 \u003d 2HCL;
CL 2 + F 2 \u003d 2CLF।
ক্লোরিন হাইড্রোজেন এবং ধাতুগুলির সাথে তাদের যৌগ থেকে ব্রোমাইন এবং আইডিনকে স্থানান্তর করতে সক্ষম:
CL 2 + 2HBR \u003d BR 2 + 2HCL;
CL 2 + 2nai \u003d আমি 2 + 2nacl।
ক্লোরিন জল এবং ক্ষারকে দ্রবীভূত করতে সক্ষম, যখন ক্লোরিন অসম্পূর্ণতার প্রতিক্রিয়া ঘটে এবং প্রতিক্রিয়া পণ্যগুলির গঠনটি তার অবস্থার উপর নির্ভর করে:
CL 2 + H 2 O ↔ HCL + HCLO;
CL 2 + 2NAOH \u003d NACL + NACLO + H 2 O;
3 CL 2 + 6NAOH \u003d 5NACL + NACLO 3 + 3H 2 ও।
ক্লোরিন অ-গঠনের অক্সাইডের সাথে যোগাযোগ করে - একটি তুচ্ছ নামের সাথে একটি পদার্থের গঠন - ফসজিন, অ্যামোনিয়ায় অ্যামোনিয়া ট্রিকলোরাইড তৈরি করতে:
CL 2 + CO \u003d COCL 2;
3 CL 2 + 4NH 3 \u003d NCL 3 + 3NH 4 CL।
প্রতিক্রিয়াগুলিতে, ক্লোরিন অক্সিডেন্টের বৈশিষ্ট্যগুলি দেখায়:
CL 2 + H 2 S \u003d 2HCL + S.
ক্লোরিন অ্যালকাইন, অ্যালেনেস এবং এরিনা শ্রেণীর জৈব পদার্থের সাথে মিথস্ক্রিয়া প্রতিক্রিয়া প্রবেশ করে:
CH 3 -Ch 3 + CL 2 \u003d CH 3 -CH 2 -CL + HCL (শর্ত - UV বিকিরণ);
CH 2 \u003d CH 2 + CL 2 \u003d CH 2 (CL) -CH 2 -CL;
সি 6 এইচ 6 + CL 2 \u003d C 6 এইচ 5 -এলএল + এইচসিএল (ক্যাট \u003d FECL 3, ALCL 3);
সি 6 এইচ 6 + 6CL 2 \u003d সি 6 এইচ 6 টি ক্ল 6 + 6 এইচসিএল (শর্ত - ইউভি বিকিরণ)।
শারীরিক বৈশিষ্ট্য ক্লোরিন
ক্লোরিন - হলুদ-সবুজ গ্যাস। টার্মিকভাবে স্থিতিশীল। ক্লোরাইড ক্লোরিনের সাথে সম্পৃক্ত হয়, একটি কঠিন ক্রিট গঠন করা হয়। এটি ভাল দ্রবণীয়, দ্রবীভূত করা ("ক্লোরিন ওয়াটার") মূলত ব্যাপকভাবে উন্মুক্ত। কার্বন Tetrachloride দ্রবীভূত করা হয়, তরল SICL 4 এবং TICL 4। খারাপভাবে সোডিয়াম ক্লোরাইড একটি saturated সমাধান মধ্যে দ্রবীভূত। অক্সিজেন সঙ্গে প্রতিক্রিয়া না। শক্তিশালী অক্সিডাইজার। উষ্ণ বিন্দু - -34.1C, গলানো - -101,03C।
ক্লোরিন পেয়ে
পূর্বে, ক্লোরিনটি শেললে (হাইড্রোক্লোরিক অ্যাসিডের সাথে ম্যাঙ্গানিজ অক্সাইড (ভিআই) এর মিথস্ক্রিয়া প্রতিক্রিয়া) দ্বারা বা ডিকন পদ্ধতি (অক্সিজেনের সাথে ক্লোরুয়ারের মিথস্ক্রিয়া প্রতিক্রিয়া) দ্বারা প্রাপ্ত হয়েছিল:
এমএনও 2 + 4HCL \u003d MNCL 2 + CL 2 + 2 ঘন্টা 2 ও;
4HCL + O 2 \u003d 2H 2 O + 2 CL 2।
আজকাল, নিম্নলিখিত প্রতিক্রিয়া ক্লোরিন প্রাপ্ত করার জন্য ব্যবহার করা হয়:
Naocl + 2hcl \u003d nacl + cl 2 + h 2 o;
2KMNO 4 + 16HCL \u003d 2KCL + 2MNCL 2 +5 CL 2 + 8H 2 O;
2nacl + 2h 2 o \u003d 2naoh + CL 2 + এইচ 2 (শর্ত - ইলেক্ট্রোলাইসিস)।
ক্লোরিন ব্যবহার
ক্লোরিন ব্যাপকভাবে শিল্পের বিভিন্ন ক্ষেত্রে ব্যবহার করা হয়েছে, তাই এটি খাদ্য শিল্পে, জলের নির্বীজনের জন্য, পলিমেরিক উপকরণ (পলিভিনাইল ক্লোরাইডিক কীটনাশক (হেক্সাহলারন), কম্ব্যাট বিষাক্ত পদার্থ (ফসজিন) উৎপাদনে ব্যবহৃত হয়, ধাতব পদার্থে, ইত্যাদি
সমস্যা সমাধানের উদাহরণ
উদাহরণ 1।
উদাহরণ 2।
| কাজটি | কি ভলিউম, ভর এবং ক্লোরিন পদার্থের পরিমাণ হাইলাইট করা হয় (এন।) হাইলাইট (এন।) হাইড্রোক্লোরিক অ্যাসিডের সাথে 17.4 গ্রামের সাথে মিথস্ক্রিয়া সহ? |
| সিদ্ধান্ত | আমরা হাইড্রোক্লোরিক অ্যাসিড সহ ম্যাগানিজ অক্সাইড (iv) এর মিথস্ক্রিয়া প্রতিক্রিয়া সমীকরণ লিখি: 4HCL + MNO 2 \u003d MNCL 2 + CL 2 + 2H 2 ও। ম্যাগানিজ অক্সাইড (iv) এবং ক্লোরিনের মোল্লার জনসাধারণ, রাসায়নিক উপাদানগুলির টেবিল ব্যবহার করে গণনা করা হয়। মেন্ডেলিভা - 87 এবং 71 গ্রাম / মোল, যথাক্রমে। মঙ্গন্দ অক্সাইডের পরিমাণ গণনা করুন (iv): এন (এমএনও 2) \u003d এম (এমএনও 2) / এম (এমএনও 2); এন (এমএনও 2) \u003d 17.4 / 87 \u003d 0.2 MOL। প্রতিক্রিয়া সমীকরণের মতে এন (এমএনও 2): এন (CL 2) \u003d 1: 1, অতএব, n (CL 2) \u003d n (mno 2) \u003d 0.2 MOL। তারপর ক্লোরিনের ভর এবং ভলিউম সমান হবে: এম (সিএল 2) \u003d 0.2 × 71 \u003d 14.2 গ্রাম; V (cl 2) \u003d n (CL 2) × ভি এম \u003d 0.2 × 22,4 \u003d 4,48 l। |
| উত্তর | ক্লোরিন পদার্থের পরিমাণ 0.2 মোল, ওজন - 14.2 গ্রাম, ভলিউম - 4.48 লিটার। |
CL 2 সম্পর্কে জন্য। টি - একটি ধারালো চপিং গন্ধ সহ হলুদ-সবুজ গ্যাস, বায়ু থেকে ভারী - 2.5 গুণ, পানিতে পানিতে (~ 6.5 গ্রাম / এল); এক্স. আর অ-মেরু জৈব দ্রাবক মধ্যে। বন্যা শুধুমাত্র আগ্নেয়গিরি গ্যাস পাওয়া যায়।
পাওয়ার জন্য পদ্ধতি
Anions এর অক্সিডেশন প্রক্রিয়ার উপর ভিত্তি করে -
2CL - - 2E - \u003d CL 2 0
শিল্প
ক্লোরাইডগুলির জলের সমাধানগুলির ইলেক্ট্রোলাইসিস, আরো প্রায়ই - NACL:
2nacl + 2n 2 o \u003d cl 2 + 2naoh + H 2
ল্যাবরেটরি
অক্সিডেশন কনস। এইচসিআই বিভিন্ন অক্সিডাইজিং এজেন্ট:
4HCI + MNO 2 \u003d CL 2 + এমপিএল 2 + \u200b\u200b2N 2 ও ২
16NSL + 2KMPO 4 \u003d 5CL 2 + 2MNCL 2 + 2KCL + 8N 2 O
6 এইচসিএল + KSLO 3 \u003d SCL 2 + KCL + 3N 2 O
14 এইচসিএল + কে 2 সিআর 2 ও 7 \u003d 3CL 2 + 2CRCL 3 + 2KCL + 7N 2 O
রাসায়নিক বৈশিষ্ট্য
ক্লোরিন একটি খুব শক্তিশালী অক্সিডাইজিং এজেন্ট। ধাতু, অ ধাতু এবং জটিল পদার্থ oxidizes, যা খুব স্থিতিশীল cl anions মধ্যে সক্রিয় -:
CL 2 0 + 2E - \u003d 2CL -
ধাতু সঙ্গে প্রতিক্রিয়া
শুষ্ক গ্যাসীয় ক্লোরিন বায়ুমন্ডলে সক্রিয় ধাতু জ্বলছে এবং পুড়িয়ে ফেলা হয়; একই সময়ে, ধাতু ক্লোরাইড গঠিত হয়।
CL 2 + 2NA \u003d 2NACL
3CL 2 + 2FE \u003d 2FECL 3
অ-কার্যকর ধাতুগুলি ভিজা ক্লোরিন বা তার জলের সমাধানগুলির সাথে অক্সিডাইজ করা সহজ:
CL 2 + CU \u003d CUCL 2
3CL 2 + 2UU \u003d 2AUCL 3
অ ধাতু সঙ্গে প্রতিক্রিয়া
ক্লোরিন সরাসরি O 2, N 2, C এর সাথে সরাসরি ইন্টারঅ্যাক্ট করেন না। প্রতিক্রিয়াগুলির অন্যান্য অ ধাতুগুলির সাথে বিভিন্ন অবস্থার অধীনে ঘটে।
Nemmetalov halides গঠিত হয়। সবচেয়ে গুরুত্বপূর্ণ হাইড্রোজেন সঙ্গে মিথস্ক্রিয়া প্রতিক্রিয়া।
CL 2 + এইচ 2 \u003d 2NC1
CL 2 + 2S (দ্রবীভূত করা) \u003d S 2 CL 2
ZCL 2 + 2R \u003d 2pcl 3 (বা PCL 5 - অতিরিক্ত CL 2)
2CL 2 + SI \u003d SICL 4
3CL 2 + I 2 \u003d 2ICL 3
তাদের যৌগ থেকে বিনামূল্যে অ ধাতু ধাতু (BR 2, I 2, N 2, গুলি) স্থানান্তর
CL 2 + 2KBR \u003d BR 2 + 2KCL
CL 2 + 2KI \u003d আমি 2 + 2kcl
CL 2 + 2hi \u003d আমি 2 + 2HCL
CL 2 + H 2 S \u003d S + 2HCL
ZSL 2 + 2NH 3 \u003d N 2 + 6 এইচসিএল
জল এবং জলীয় ক্ষার সমাধান মধ্যে অসম্পূর্ণতা ক্লোরিন
স্ব-seducing-স্ব-নিরাময়ের ফলে, কিছু ক্লোরিন পরমাণুতে রূপান্তরিত হয়, এবং অন্যান্যদের একটি ইতিবাচক ডিগ্রী অক্সিডেশনগুলিতে ক্লো বা ক্লো 3 এশিয়াতে অন্তর্ভুক্ত করা হয়।
CL 2 + H 2 O \u003d HCL + NCLO HLORNOTY K-TA
CL 2 + 2CCON \u003d KCL + KCLO + H 2 O
3CL 2 + 6con \u003d 5kcl + KCLO 3 + 3N 2 O
3CL 2 + 2S (এটি) 2 \u003d CACL 2 + CA (CLO) 2 + 2N 2 O O
এই প্রতিক্রিয়াগুলি গুরুত্বপূর্ণ কারণ ক্লোরিন অক্সিজেন যৌগগুলি প্রাপ্ত হয়:
KCLO 3 এবং CA (CLO) 2 - HYPOCHLORITES; KCLO 3 - পটাসিয়াম ক্লোর্যাট (Burtupolet লবণ)।
জৈব পদার্থ সঙ্গে ক্লোরিন এর মিথস্ক্রিয়া
একটি) অণু মধ্যে হাইড্রোজেন পরমাণু প্রতিস্থাপন
খ) একাধিক কার্বন-কার্বন বন্ধনের ভঙ্গের স্থানে অণু CL 2 যোগ করুন
এইচ 2 সি \u003d সিএইচ 2 + ক্ল 2 → CLH 2 C-CH 2 CL 1,2-Dichloroethane
HC≡ch + 2CL 2 → CL 2 এইচসি-সিএলসিএল 2 1,1,2,2-টিট্রাক্লোরোথেন
ক্লোরাইড এবং হাইড্রোক্লোরিক অ্যাসিড
গ্যাসীয় ক্লোরাইড
প্রাকৃতিক ও রাসায়নিক বৈশিষ্ট্য
এইচসিএল - হাইড্রোজেন ক্লোরাইড। সম্পর্কে জন্য টি - BESZV। একটি ধারালো গন্ধ দিয়ে গ্যাস, বেশ সহজে তরল (টি। পিএল -114 ডিগ্রি সেলসিয়াস, এত কঠিন। -85 ডিগ্রি সেলসিয়াস)। অ্যানড্রাইডাস এইচসিএল এবং গ্যাসীয়, এবং অ-ইলেক্ট্রো-পরিবহনের তরল অবস্থায়, রাসায়নিকভাবে ধাতু, অক্সাইড এবং ধাতুগুলির হাইড্রক্সাইডগুলির সাথে পাশাপাশি অন্যান্য পদার্থের সাথে সম্পর্কিত। এর মানে হল যে পানি অনুপস্থিতিতে, ক্লোরাইড অ্যাসিড বৈশিষ্ট্যগুলি দেখায় না। শুধুমাত্র খুব উচ্চ টি গ্যাসযুক্ত এইচসিএল মেটালগুলির সাথে প্রতিক্রিয়া জানায় এবং এমনকি সিইউ এবং এজি হিসাবে কম সক্রিয়।
এইচসিএল-তে হিপ্পাইড-আনিয়ানের পুনর্নির্মাণের বৈশিষ্ট্যগুলিও সামান্য ডিগ্রীতে প্রকাশ করা হয়: এটি প্রায় ফ্লোরিন দ্বারা অক্সিডাইস করা হয়। টি, পাশাপাশি একটি উচ্চ টি (600 ডিগ্রি সেলসিয়াস) ক্যাটালিস্টের উপস্থিতিতে প্রতিক্রিয়াগুলি অক্সিজেনের সাথে প্রতিক্রিয়া দেখায়:
2HCL + F 2 \u003d CL 2 + 2HF
4HCL + O 2 \u003d 2SL 2 + 2N 2 O
এইচসিএল গ্যাস ব্যাপকভাবে জৈব সংশ্লেষণ (হাইড্রোক্লোরিনেশন প্রতিক্রিয়া) ব্যবহৃত হয়।
পাওয়ার জন্য পদ্ধতি
1. সহজ পদার্থ সংশ্লেষণ:
এইচ 2 + CL 2 \u003d 2HCL
2. হাইকোর্টের ক্লোরিং যখন এটি একটি দ্বারা পণ্য হিসাবে গঠিত হয়:
R-H + CL 2 \u003d R-CL + HCL
3. পরীক্ষাগারে কংক্রিট দ্বারা প্রাপ্ত করা হয়। ক্লোরাইডগুলির জন্য 2 তাই 4 তাই 4:
এইচ 2 তাই 4 (কনস।) + NACL \u003d 2HCL + নাহো 4 (দুর্বল গরমের সাথে)
এইচ 2 তাই 4 (কনস।) + 2NACL \u003d 2HCL + NA 2 তাই 4 (খুব শক্তিশালী গরম করার সাথে)
এইচসিএল জলজ সমাধান - গুরুতর অ্যাসিড (ক্লোরাইড, বা হাইড্রোক্লোরিক)
এইচসিএল জল খুব ভাল দ্রবণীয়: জন্য। টি 1 এল এইচ 2 o দ্রবীভূত হয় ~ 450 লিটার গ্যাস (দ্রবীভূতকরণের একটি উল্লেখযোগ্য পরিমাণের মুক্তির দ্বারা সংসর্গী হয়)। একটি সম্পৃক্ত সমাধানটি এইচসিএল এর ভর ভগ্নাংশ, 36-37% এর সমান। এই সমাধান একটি খুব ধারালো, গন্ধ suffocating আছে।
জলের মধ্যে এইচসিএল অণু আয়ন প্রায় সম্পূর্ণরূপে বিচ্ছিন্ন হয়, I.E., HCL এর একটি জটিল সমাধান একটি শক্তিশালী অ্যাসিড।
হাইড্রোক্লোরিক এসিডের রাসায়নিক বৈশিষ্ট্য
1. জল এইচসিএল মধ্যে দ্রবীভূত জল এইচ + আয়ন উপস্থিতির কারণে অ্যাসিডের সমস্ত সাধারণ বৈশিষ্ট্য প্রদর্শন করে
এইচসিএল → এইচ + + CL -
মিথষ্ক্রিয়া:
ক) ধাতু দিয়ে (বিসি):
2 এইচসিএল 2 + \u200b\u200bZN \u003d ZNCL 2 + H 2
খ) মৌলিক এবং অ্যাম্ফোটেরিক অক্সাইডগুলির সাথে:
2hcl + cuo \u003d cucl 2 + এইচ 2 ও
6 এইচসিএল + আল 2 ও 3 \u003d 2ALCL 3 + ZN 2 ও
গ) বেস এবং অ্যাম্ফোটেরিক হাইড্রক্সাইডস সহ:
2HCL + SA (এটা) 2 \u003d CACL 2 + 2N 2 ও
3 এইচসিএল + আল (এটা) 3 \u003d ALSL 3 + ZN 2 ও
ঘ) দুর্বল অ্যাসিডের লবণের সাথে:
2hcl + Saco 3 \u003d CACL 2 + CO 2 + H 3 O
এইচসিএল + সি 6 এইচ 5 ওএনএ \u003d সি 6 এন 5 উপর + NACL
ই) অ্যামোনিয়া সঙ্গে:
এইচসিএল + এনএইচ 3 \u003d এনএইচ 4 সিএল
শক্তিশালী অক্সিডাইজিং এজেন্ট F 2, এমএনও 2, KMNO 4, KCLO 3, K 2 CR 2 O 7। আনিয়ন ক্ল - হ্যালোজেন বিনামূল্যে অক্সিডাইসেড:
2CL - - 2E - \u003d CL 2 0
প্রতিক্রিয়া সমীকরণ দেখুন "ক্লোরিন পেয়ে"। বিশেষ গুরুত্ব হাইড্রোক্লোরিক এবং নাইট্রিক অ্যাসিডের মধ্যে OSR হয়:

জৈব যৌগ সঙ্গে প্রতিক্রিয়া
মিথষ্ক্রিয়া:
একটি) আমিনস (জৈব ভিত্তিতে হিসাবে)
R-NH 2 + HCL → + CL -
খ) এমিনো অ্যাসিডের সাথে (অ্যামফোটারড সংযোগ হিসাবে)

অক্সাইড এবং oxocuslots ক্লোরিন
অ্যাসিড অক্সাইড.

অ্যাসিড

Sololi।
রাসায়নিক বৈশিষ্ট্য
1. সমস্ত ক্লোরিন oxocosls এবং তাদের লবণ শক্তিশালী অক্সিডাইজিং এজেন্ট।
2. তাপমাত্রা সময় প্রায় সব যৌগ intramolecular অক্সিডেশন-পুনরুদ্ধারের বা অসম্পূর্ণ কারণে decomposed হয়।

Bleaching পাউডার
ক্লোরিন (বেলেন) চুন - হাইপোল্লোরাইট এবং ক্যালসিয়াম ক্লোরাইডের মিশ্রণ, একটি সাদা এবং নির্বীজিত প্রভাব রয়েছে। কখনও কখনও এটি একটি মিশ্র লবণ একটি উদাহরণ হিসাবে বিবেচিত হয়, যা তার গঠন একই সময়ে দুই অ্যাসিড এর আংশিক:

Zhawl জল।
ক্লোরাইড এবং গ্যাপোক্লোরাইট পটাসিয়াম কিলিক্যাল সমাধান + + kclo + এইচ 2 ও
ক্লোরিনের উদাহরণে প্রধান উপগোষ্ঠীর VII গোষ্ঠীর উপাদানের বৈশিষ্ট্যগুলি বৈশিষ্ট্য
উপগোষ্ঠীর সাধারণ বৈশিষ্ট্য
টেবিল 1. উপগোষ্ঠীর উপাদানের উপাদানগুলির নামকরণ
পি-উপাদান, সাধারণত, অ ধাতু (astat - semimetal), hallogens।
বৈদ্যুতিন উপাদান চার্ট হাল (হাল ≠ F):
উপগোষ্ঠীর উপাদানের জন্য নিম্নলিখিত Vialen দ্বারা চিহ্নিত করা হয়:
টেবিল 2. Valence.
3. উপগোষ্ঠীর ভিয়ায়ার উপাদানের জন্য, নিম্নলিখিত অক্সিডেশন ডিগ্রীগুলি চরিত্রগত:
টেবিল 3. উপাদান অক্সিডেশন ডিগ্রী
রাসায়নিক উপাদান চরিত্রগত
ক্লোরিন - উপাদান VII একটি গ্রুপ। সিরিয়াল নম্বর 17।
আপেক্ষিক পারমাণবিক ওজন: 35,4527 এ। ই। মি। (জি / MOL)
 প্রোটন সংখ্যা, নিউট্রন, ইলেকট্রন: 17,18,17
প্রোটন সংখ্যা, নিউট্রন, ইলেকট্রন: 17,18,17
পরমাণু গঠন:
![]()
বৈদ্যুতিন সূত্র:
অক্সিডেশন এর সাধারণ ডিগ্রী: -1, 0, +1, +3, +4, +5, +7
Ionization শক্তি: 1254.9 (13.01) কেজি / mol (EV)
ইলেক্ট্রন এফিনিটি: 349 (কেজে / MOL)
পলংগা বিদ্যুৎ: 3.20
একটি সহজ পদার্থ চরিত্রগত
যোগাযোগের ধরন: চুক্তির অ-মেরু
ডাবল অণু
আইসোটোপস: 35 সিএল (75.78%) এবং 37 সিএল (24.2২%)
ক্রিস্টাল ল্যাটিস এর ধরন: আণবিক
থার্মোডাইনামিক পরামিতি
টেবিল 4।
শারীরিক বৈশিষ্ট্য
সারণী 5।
রাসায়নিক বৈশিষ্ট্য
ক্লোরিন এর জলের সমাধান মূলত dismantized হয় ("ক্লোরিন জল")
1 পর্যায়: CL 2 + H 2 O \u003d HCL + HOCL
2 পর্যায়: HOCL \u003d HCL + [ও] - পারমাণবিক অক্সিজেন
উপগোষ্ঠীর অক্সিডেটিভ ক্ষমতা ফ্লোরাইড থেকে আইডিন \u003d ˃ থেকে হ্রাস পায়
ক্লোরিন শক্তিশালী অক্সিডাইজার:
1. সহজ পদার্থ সঙ্গে মিথস্ক্রিয়া
একটি) হাইড্রোজেন সঙ্গে:
CL 2 + এইচ 2 \u003d 2 এইচসিএল
খ) ধাতু দিয়ে:
CL 2 + 2NA \u003d 2NACL
3CL 2 + 2FE \u003d 2FECL 3
গ) কিছু কম বৈদ্যুতিক নেতিবাচক অ ধাতু দিয়ে:
3CL 2 + 2P \u003d 2pcl 3
CL 2 + S \u003d SCL 2
অক্সিজেন, কার্বন এবং নাইট্রোজেন ক্লোরিন সরাসরি সঙ্গে প্রতিক্রিয়া না!
2. জটিল পদার্থ সঙ্গে মিথস্ক্রিয়া
একটি) জল দিয়ে: উপরে দেখুন
খ) অ্যাসিডের সাথে: প্রতিক্রিয়া না!
গ) আলক্লিস সমাধানগুলির সাথে:
ঠান্ডা উপর: CL 2 +2 naoh \u003d nacl + naclo + এইচ 2 ও
উত্তপ্ত যখন: 3CL 2 + 6 KOH \u003d 5KCL + KCLO 3 + 3H 2 O
ই) অনেক জৈব পদার্থের সাথে:
CL 2 + CH 4 \u003d CH 3 CL + HCL
সি 6 এইচ 6 + ক্লিপি 2 \u003d সি 6 এইচ 5 ক্ল + এইচসিএল
সবচেয়ে গুরুত্বপূর্ণ যৌগ ক্লোরিন
 ক্লোরাইড হাইড্রোজেন ক্লোরাইড(এইচসিএল) - রঙিন, তাপগতভাবে স্থায়ী গ্যাস (স্বাভাবিক অবস্থার অধীনে), একটি ধারালো গন্ধ সহ, ভিজা বাতাসে ধূমপান, সহজে পানিতে দ্রবীভূত করা হয় (জলের পরিমাণের পরিমাণ 500 গ্যাস ভলিউমের পরিমাণের পরিমাণ) অ্যাসিড গঠনের সাথে। এ -114.22 ডিগ্রি সেলসিয়াস এইচসিএল একটি কঠিন অবস্থায় যায়। একটি কঠিন অবস্থায়, ক্লোরাইডটি দুটি স্ফটিক পরিবর্তনের আকারে রয়েছে: রম্বিক, নীচের স্থিতিশীল এবং ঘনক।
ক্লোরাইড হাইড্রোজেন ক্লোরাইড(এইচসিএল) - রঙিন, তাপগতভাবে স্থায়ী গ্যাস (স্বাভাবিক অবস্থার অধীনে), একটি ধারালো গন্ধ সহ, ভিজা বাতাসে ধূমপান, সহজে পানিতে দ্রবীভূত করা হয় (জলের পরিমাণের পরিমাণ 500 গ্যাস ভলিউমের পরিমাণের পরিমাণ) অ্যাসিড গঠনের সাথে। এ -114.22 ডিগ্রি সেলসিয়াস এইচসিএল একটি কঠিন অবস্থায় যায়। একটি কঠিন অবস্থায়, ক্লোরাইডটি দুটি স্ফটিক পরিবর্তনের আকারে রয়েছে: রম্বিক, নীচের স্থিতিশীল এবং ঘনক।
হাইড্রোজেন ক্লোরাইডের একটি জটিল সমাধান হাইড্রোক্লোরিক অ্যাসিড বলা হয়। যখন পানি দ্রবীভূত হয়, তখন নিম্নলিখিত প্রক্রিয়াগুলি এগিয়ে যায়:
HCL R + H 2 O W \u003d H 3 O + F + CL -
বিচ্ছেদ প্রক্রিয়া অত্যন্ত exothermic হয়। জল এইচসিএল সঙ্গে Azeotropic মিশ্রণ ফর্ম। এটি একটি শক্তিশালী monosocond অ্যাসিড। হাইড্রোজেনের বামে বেশ কয়েকটি ভোল্টেজে দাঁড়িয়ে থাকা সমস্ত ধাতুগুলির সাথে একত্রিত হয়, মৌলিক এবং অ্যাম্ফোটেরিক অক্সাইড, বেস এবং লবণগুলি, লবণ গঠন করে - ক্লোরিডা:
এমজি + 2 এইচসিএল → এমজিসিএল 2 + \u200b\u200bএইচ 2
FEO + 2 HCL → FECL 2 + H 2 ও
শক্তিশালী অক্সিডাইজিং এজেন্টগুলির কর্মকাণ্ডের অধীনে বা ইলেক্ট্রোলাইসিসের সাথে, ক্লোরাইড বৈশিষ্ট্যগুলি হ্রাস করে:
এমএনও 2 + 4 এইচসিএল → এমএনসিএল 2 + \u200b\u200bCL 2 + 2 এইচ 2 ও
গরম করার সময়, ক্লোরাইড অক্সিজেনের সাথে অক্সিডাইজড হয় (ক্যাটালিস্ট - কোকিক ২ ক্লোরাইড (২) 2):
4 এইচসিএল + ও 2 → 2 এইচ 2 ও +2 ক্ল 2
যাইহোক, ঘনীভূত হাইড্রোক্লোরিক এসিড তামার সঙ্গে প্রতিক্রিয়া, সমান্তরাল তামা জটিল গঠিত হয়:
2 CU + 4 HCL → 2 এইচ + এইচ 2
ঘনীভূত হাইড্রোক্লোরিকের 3 টি ভলিউম অংশ এবং ঘনীভূত নাইট্রিক অ্যাসিডের 1 ভলিউম ভগ্নাংশের মিশ্রণটি "Tsarist ভদকা" বলা হয়। রয়াল ভদকা এমনকি গোল্ড এবং প্ল্যাটিনাম দ্রবীভূত করতে সক্ষম। রাজকীয় ভদকা এর উচ্চ অক্সিডেটিভ ক্রিয়াকলাপটি নাইট্রোজেন এবং ক্লোরিন ক্লোরাইডের উপস্থিতির কারণে, যা উৎস পদার্থের সাথে ভারসাম্যপূর্ণ হয়:
4 এইচ 3 O + + 3 CL - + না 3 - \u003d NOCL + CL 2 + 6 এইচ 2 ও
একটি সমাধান মধ্যে ক্লোরাইড আয়ন উচ্চ ঘনত্বের কারণে, ধাতু একটি ক্লোরাইড জটিল সঙ্গে যুক্ত করা হয়, যা তার দ্রবীভূত করতে অবদান রাখে:
3 PT + 4 HNO 3 + 18 এইচসিএল → 3 এইচ 2 + 4 না + 8 এইচ 2 ও
ক্লোরুয়ারের জন্য, একাধিক সম্পর্কের প্রতিক্রিয়া (ইলেক্ট্রোফিলি সংযোগ) এছাড়াও চরিত্রগত:
R-CH \u003d CH 2 + HCL → R-CHCL-CH 3
R-C≡ch + 2 HCL → R-CCL 2 -CH 3
ক্লোরিন অক্সাইড - ক্লোরিন এবং অক্সিজেন এর অজৈব রাসায়নিক যৌগ, সাধারণ সূত্র: CL X O.
ক্লোরিন নিম্নলিখিত অক্সাইড তৈরি করে: CL 2 O, CL 2 O 3, CLO 2, CL 2 O 4, CL 2 O 6, CL 2 O 7। উপরন্তু, একটি স্বল্পকালীন ক্লোরিন এবং একটি মৌলবাদী ক্লোরিন টেট্রক্সাইড ক্লো 4 র্যাডিকাল একটি স্বল্পকালীন ক্লোরিন একটি মৌলবাদী।
টেবিলের নীচে স্থিতিশীল ক্লোরিন অক্সাইডের বৈশিষ্ট্যগুলি দেখায়:
টেবিল 6।
| সম্পত্তি | CL 2 ও। | Clo 2। | Cloclo 3। | CL 2 ও 6 (জি) ↔2CLO 3 (জি) | CL 2 ও 7 |
| বিছানা সঙ্গে রঙ এবং অবস্থা। তাপমাত্রা | ধূসর-বাদামী গ্যাস | ধূসর সবুজ গ্যাস | হালকা হলুদ তরল | গাঢ় লাল তরল | বর্ণহীন তরল |
| অক্সিডেশন ক্লোরিন ডিগ্রী | (+1) | (+4) | (+1), (+7) | (+6) | (+7) |
| টি। পি।, ডিগ্রি সেলসিয়াস | −120,6 | −59 | −117 | 3,5 | −91,5 |
| টি। কিপ।, ° সে | 2,0 | 44,5 | |||
| ডি। (এফ, 0 ডিগ্রি সেলসিয়াস), জি * সিএম -3 | - | 1,64 | 1,806 | - | 2,02 |
| Δh ° ORG (GAZ, 298 K), KJ * MOL -1 | 80,3 | 102,6 | ~180 | (155) | |
| Δ জি ° CPA (গাজ, ২98 কে), কেজে * MOL -1 | 97,9 | 120,6 | - | - | - |
| এস ° ORG (GAZ, 298 কে), জে * কে -1 * MOL -1 | 265,9 | 256,7 | 327,2 | - | - |
| ডিপোল মুহূর্ত μ, ডি | 0.78 ± 0.08. | 1.78 ± 0.01. | - | - | 0.72 ± 0.02। |
 ক্লোরিন অক্সাইড (আমি), Dichlor এর অক্সাইড, ক্লোরোটিক এসিড এনহাইড্রাইড - অক্সিজেন সঙ্গে অক্সিডেশন ডিগ্রী মধ্যে ক্লোরিন যৌগিক।
ক্লোরিন অক্সাইড (আমি), Dichlor এর অক্সাইড, ক্লোরোটিক এসিড এনহাইড্রাইড - অক্সিজেন সঙ্গে অক্সিডেশন ডিগ্রী মধ্যে ক্লোরিন যৌগিক।
স্বাভাবিক অবস্থার অধীনে, এটি একটি ব্রাউন-হলুদ গ্যাস যা ক্লোরিন গন্ধ অনুরূপ একটি চরিত্রগত গন্ধ। 2 ডিগ্রি সেলসিয়নের নিচে তাপমাত্রায় - গোল্ডেন-লাল তরল। বিষাক্ত: শ্বাসযন্ত্রের ট্র্যাক্ট স্ট্রাইক। স্বতঃস্ফূর্তভাবে ধীরে ধীরে বিচ্ছেদ:
বড় ঘনত্ব বিস্ফোরক হয়। স্বাভাবিক অবস্থার অধীনে ঘনত্ব 3.22 কেজি / মি। একটি চার ক্লোরাইড কার্বন মধ্যে দ্রবীভূত করা। দুর্বল chöröoticotic অ্যাসিড গঠনের সাথে ভাল দ্রবণীয়:
দ্রুত alkalis সঙ্গে প্রতিক্রিয়া:
CL 2 ও + 2naoh (আরএসসি) \u003d 2naclo + এইচ 2 ও
ক্লোরিন ডাই অক্সাইড - অ্যাসিড অক্সাইড। যখন পানি দ্রবীভূত হয়, ক্লোরাইড এবং ক্লোরিনেটেড অ্যাসিড (অসম্পূর্ণতা প্রতিক্রিয়া) গঠিত হয়। Diluted সমাধান অন্ধকারে প্রতিরোধী, হালকা ধীরে ধীরে decomposed হয়:
 ক্লোরিন ডাই অক্সাইড - ক্লোরিন অক্সাইড ( চতুর্থ।), ক্লোরিন এবং অক্সিজেন যৌগ, সূত্র: ক্লো 2।
ক্লোরিন ডাই অক্সাইড - ক্লোরিন অক্সাইড ( চতুর্থ।), ক্লোরিন এবং অক্সিজেন যৌগ, সূত্র: ক্লো 2।
স্বাভাবিক অবস্থার অধীনে, Clo 2 একটি লাল-হলুদ গ্যাস গ্যাস, একটি চরিত্রগত গন্ধ সঙ্গে। 10 ডিগ্রি সেলসিয়াস ক্লো 2 এর নিচে তাপমাত্রায় একটি লাল-বাদামী তরল। Oxidizing এজেন্ট সঙ্গে যোগাযোগের সময়, হালকাভাবে প্রতিরোধী, আলোর বিস্ফোরণ এবং যখন উত্তপ্ত। ভাল দ্রবণীয় দ্রাবক। ক্লোরিন ডাই অক্সাইডের বিস্ফোরণের কারণে, তরল আকারে সংরক্ষণ করা অসম্ভব।
অ্যাসিড অক্সাইড। যখন পানি দ্রবীভূত হয়, ক্লোরাইড এবং ক্লোরিনেটেড অ্যাসিড (অসম্পূর্ণতা প্রতিক্রিয়া) গঠিত হয়। Diluted সমাধান অন্ধকারে প্রতিরোধী, হালকা ধীরে ধীরে decomposed হয়:
ফলে ক্লোরাইড অ্যাসিড খুব অস্থির এবং decomposed হয়:
Redox বৈশিষ্ট্য দেখায়।
2 + 5 এইচ 2 SO 4 (RSC) + 10Feso 4 \u003d 5FE 2 (SO 4) 3 + 2HCL + 4H 2 ও 2
Clo 2 + 2naoh গরম। \u003d Naclo 2 + naclo 3 + এইচ 2 ও
CLO 2 + O 3 \u003d CLO 3 + O 2
Clo 2 জৈব যৌগের সাথে অনেকের সাথে প্রতিক্রিয়া করে এবং মধ্যবিত্তের অক্সিডাইজিং এজেন্ট সঞ্চালন করে।
 Chloornanic অ্যাসিড - এইচসিএলও, খুব দুর্বল মনোসোকন্ড অ্যাসিড, যা ক্লোরিনের একটি ডিগ্রী অক্সিডেশন +1 আছে। শুধুমাত্র সমাধান আছে।
Chloornanic অ্যাসিড - এইচসিএলও, খুব দুর্বল মনোসোকন্ড অ্যাসিড, যা ক্লোরিনের একটি ডিগ্রী অক্সিডেশন +1 আছে। শুধুমাত্র সমাধান আছে।
জলের সমাধানগুলিতে, ক্লোরোটিক এসিড আংশিকভাবে প্রোটন এবং হাইপোক্লোরাইট-আনিয়ন ক্লোতে বিচ্ছিন্ন করে -:
অস্থিতিশীল. Chlornanotic এসিড এবং তার লবণ - hypochlorites. - শক্তিশালী oxidizers। এইচসিএল হাইড্রোক্লোরিক অ্যাসিডের সাথে প্রতিক্রিয়াগুলি, একটি আণবিক ক্লোরিন গঠন করে:
HCLO + NAOH (RSC) \u003d NACLO + H 2 O 
চকচকে অ্যাসিড - এইচসিএল 2, মাঝারি শক্তি একক অক্ষ এসিড।
ক্লোরাইড অ্যাসিড এনক্লো 2 অস্থির আকারে, এমনকি একটি পাতলা জলের সমাধান এমনকি এটি দ্রুত decomposes:
Alkalis দ্বারা নিরপেক্ষ।
HCLO 2 + NAOH (RSC। গরম।) \u003d NACLO 2 + H 2 ও
এই অ্যাসিড এর Anhydride অজানা।
অ্যাসিড সমাধান তার লবণ থেকে প্রাপ্ত করা হয় - ক্লোরাইট.একটি পিচ সঙ্গে clo 2 এর মিথস্ক্রিয়া থেকে ফলে:
Redox বৈশিষ্ট্য মুছে ফেলা হয়।
5hclo 2 + 3 ঘন্টা 2 SO 4 (আরএসসি) + 2KMNO 4 \u003d 5HCLO 3 + 2MNSO 4 + K 2 তাই 4 + 3H 2 O 2
 ক্লোরিক অ্যাসিড - HCLO 3, শক্তিশালী MonosoCond অ্যাসিড, যা ক্লোরিন একটি ডিগ্রী অক্সিডেশন +5 আছে। বিনামূল্যে ফর্ম প্রাপ্ত হয় না; ঠান্ডা 30% নীচের একটি ঘনত্ব মধ্যে জলের সমাধান বেশ স্থিতিশীল হয়; আরো ঘনীভূত সমাধান, disintegrates:
ক্লোরিক অ্যাসিড - HCLO 3, শক্তিশালী MonosoCond অ্যাসিড, যা ক্লোরিন একটি ডিগ্রী অক্সিডেশন +5 আছে। বিনামূল্যে ফর্ম প্রাপ্ত হয় না; ঠান্ডা 30% নীচের একটি ঘনত্ব মধ্যে জলের সমাধান বেশ স্থিতিশীল হয়; আরো ঘনীভূত সমাধান, disintegrates:
Chloornic অ্যাসিড - একটি শক্তিশালী অক্সিডাইজার; বৃদ্ধি ঘনত্ব এবং তাপমাত্রা সঙ্গে অক্সিডেটিভ ক্ষমতা বৃদ্ধি পায়। HCLO 3 সহজেই হাইড্রোক্লোরিক অ্যাসিড পুনরুদ্ধার করা হয়েছে:
এইচসিএলও 3 + 5 এইচসিএল (কনস।) \u003d 3CL 2 + 3 এইচ 2 ও
HCLO 3 + NAOH (SPZ।) \u003d NACLO 3 + H 2 O
যখন তাই 2 এবং বায়ু মিশ্রণ দৃঢ়ভাবে অ্যাসিডিক সমাধান মাধ্যমে পাস করা হয়, ক্লোরিন ডাই অক্সাইড গঠিত হয়:
40% ক্লোরিনিক অ্যাসিড অগ্নিতে, উদাহরণস্বরূপ, ফিল্টার কাগজ।
8. প্রকৃতি খোঁজা:
পৃথিবীর ক্রাস্ট ক্লোরিন সবচেয়ে সাধারণ হ্যালোজেন। যেহেতু ক্লোরিন খুব সক্রিয়, প্রকৃতির এটি শুধুমাত্র খনিজগুলির যৌগের আকারে পাওয়া যায়।
টেবিল 7. প্রকৃতি খোঁজা
টেবিল 7. খনিজ ফর্ম
সমুদ্র ও মহাসাগরের লবণের রচনায় বৃহত্তম ক্লোরিন রিজার্ভ রয়েছে।
প্রাপ্তি
ক্লোরিন উত্পাদন জন্য রাসায়নিক পদ্ধতি অকার্যকর এবং খরচ। আজ পর্যন্ত, তারা প্রধানত ঐতিহাসিক গুরুত্ব। এটি হাইড্রোক্লোরিক অ্যাসিডের সাথে পটাসিয়াম পারমঙ্গানেটের মিথস্ক্রিয়ায় প্রাপ্ত করা যেতে পারে:
শেল পদ্ধতি
প্রাথমিকভাবে, ক্লোরিন প্রাপ্তির জন্য শিল্প পদ্ধতিটি শেললে, অর্থাৎ, হাইড্রোক্লোরিক এসিডের সাথে পাইরো-হাইড্রোক্লোরাইড প্রতিক্রিয়াটি ছিল:
পদ্ধতি ডিকন
ক্লোরিয়াল এয়ার অক্সিজেনের অনুঘটকীয় অক্সিডেশন সহ ক্লোরিন তৈরি করার পদ্ধতি।
ইলেক্ট্রোকেমিক্যাল পদ্ধতি
আজ, একটি শিল্প স্কেলে ক্লোরিন সোডিয়াম লবণের সমাধানটির ইলেক্ট্রোলিসিস দ্বারা সোডিয়াম হাইড্রক্সাইড এবং হাইড্রোজেনের সাথে একসাথে প্রাপ্ত হয়, যার মূল প্রক্রিয়াগুলি মোট সূত্র দ্বারা জমা দেওয়া যেতে পারে:
অ্যাপ্লিকেশন
ক্লোরিন ধারণকারী পলিমার তৈরি উইন্ডো প্রোফাইল
Bleaching এর প্রধান উপাদান labarracova জল (সোডিয়াম হাইপোল্লোরাইট)
Polyvinyl ক্লোরাইড, প্লাস্টিক, সিন্থেটিক রাবার উত্পাদন উত্পাদন।
ক্লোরোজিকের উৎপাদন। উত্পাদিত ক্লোরিন একটি উল্লেখযোগ্য অংশ উদ্ভিদ সুরক্ষা সরঞ্জাম ব্যয় করা হয়। সবচেয়ে গুরুত্বপূর্ণ কীটনাশকগুলির মধ্যে একটি হল হেক্সক্ললারক্লোহকেক্সেন (প্রায়শই হেক্সাচলোরান নামে পরিচিত)।
· একটি কম্ব্যাট বিষাক্ত পদার্থ হিসাবে ব্যবহৃত হয়, সেইসাথে অন্যান্য কম্ব্যাট বিষাক্ত পদার্থের উৎপাদনের জন্য ব্যবহৃত হয়: ইপ্রিটি, ফসজিন।
জল নির্বোধের জন্য - "ক্লোরিনেশন"।
খাদ্য শিল্প একটি খাদ্যতালিকাগত পরিপূরক E925 হিসাবে নিবন্ধিত হয়।
হাইড্রোক্লোরিক অ্যাসিড, ক্লোরিন চুন, বার্টোলেন লবণ, মেটাল ক্লোরাইড, পশম, ওষুধ, সার ব্যবহার করে রাসায়নিক উত্পাদন।
বিশুদ্ধ ধাতু উৎপাদনের জন্য ধাতব পদার্থে: টাইটানিয়াম, টিন, তান্তালুম, এনবিয়ামিয়াম।
ক্লোরিন-আর্গন ডিটেক্টরগুলিতে সৌর নিউট্রিনগুলির সূচক হিসাবে।
অনেক উন্নত দেশগুলি প্রতিদিনের জীবনে ক্লোরিন ব্যবহারকে সীমিত করতে চায়, যার মধ্যে ক্লোরিন ধারণকারী আবর্জনা জ্বলন সহকারে ডাইঅক্সিনগুলির একটি উল্লেখযোগ্য পরিমাণ গঠিত হয়।
ক্লোরিন সম্ভবত আরো অ্যালকিমিস্ট পেয়েছেন, কিন্তু তার আবিষ্কার এবং প্রথম গবেষণায় বিখ্যাত সুইডিশ রসায়নবিদ কার্ল উইলহেল শেলেলের নামে অনিচ্ছাকৃতভাবে যুক্ত ছিল। শেললে পাঁচটি রাসায়নিক উপাদান খোলা - বারিয়াম এবং ম্যাঙ্গানিজ (একসঙ্গে ইউহান গণ), মোলিবডেনাম, টংস্টেন, ক্লোরিন, এবং অন্য রসায়নবিদদের (যদিও পরে) - আরও তিনটি: অক্সিজেন, হাইড্রোজেন এবং নাইট্রোজেন। এই কৃতিত্ব পরবর্তীতে কোন রসায়নবিদ পুনরাবৃত্তি করতে অক্ষম ছিল। একই সময়ে, সুইডিশ রয়্যাল একাডেমি অফ সায়েন্সেসের সদস্যের একজন সদস্য নির্বাচিত শেললে, শেভিংয়ের একটি সাধারণ ফার্মাসিস্ট ছিলেন, যদিও তিনি আরও বেশি সম্মানিত এবং মর্যাদাপূর্ণ অবস্থান নিতে পারেন। ফ্রেডরিচ দ্বিতীয় মহান, প্রুশিয়ান কিং, তাকে বার্লিন বিশ্ববিদ্যালয়ের রসায়ন বিভাগের অধ্যাপক পদে নেমেছিলেন। যেমন প্রলুব্ধকর প্রস্তাব প্রত্যাখ্যান করে, সিলেল বলেন, "আমি আমার চেয়ে বেশি খেতে পারব না, এবং আমি এখানে চেপে যা উপার্জন করি, আমার কাছে খাদ্যের জন্য যথেষ্ট আছে।"
শেললে অনেক আগে, অবশ্যই, অনেক ক্লোরিন যৌগ পরিচিত ছিল। এই উপাদানটি সবচেয়ে বিখ্যাত - টেবিল লবণ সহ অনেক লবণের অংশ। 1774 সালে, শেললে ফ্রি ফর্মে ক্লোরিন হাইলাইট করে, ঘন ঘন হাইড্রোক্লোরিক অ্যাসিডের সাথে কালো খনিজ পিরোলিউশনটি গরম করে: এমএনও 2 + 4 এইচসিএল ® সিএল 2 + \u200b\u200bএমএনসিএল 2 + \u200b\u200b2 এইচ 2 ও।
প্রাথমিকভাবে, রসায়নবিদরা ক্লোরিনকে একটি উপাদান হিসাবে না বলে মনে করেন, কিন্তু অক্সিজেনের সাথে মুরিয়া একটি অজানা উপাদান (ল্যাটিন মুরিয়া - ব্রাইন থেকে) একটি অজানা উপাদান হিসাবে রাসায়নিক যৌগ হিসাবে। এটি বিশ্বাস করা হয়েছিল যে হাইড্রোক্লোরিক এসিড বিশ্বাস করা হয়েছিল (এটি মুরাল নামে পরিচিত) রাসায়নিকভাবে আবদ্ধ অক্সিজেন রয়েছে। এই "সাক্ষ্যপ্রাপ্ত", বিশেষ করে, যেমন একটি সত্য: যখন ক্লোরিনের সমাধান দাঁড়িয়ে থাকে তখন অক্সিজেন এটি থেকে মুক্তি পায় এবং হাইড্রোক্লোরিক অ্যাসিডটি সমাধানে থাকে। তবে, ক্লোরিন থেকে অক্সিজেন থেকে অক্সিজেন থেকে "টিয়ার অফ টিয়ার" করার অনেক প্রচেষ্টা কিছু হতে পারে না। সুতরাং, কেউ কার্বন ডাই অক্সাইড পাওয়ার জন্য পরিচালিত হয় না, কয়লা দিয়ে ক্লোরিন গরম করার জন্য (যা উচ্চ তাপমাত্রায় এটি "ধারণ করে" এটি ধারণকারী অনেক যৌগ থেকে অক্সিজেন)। গমফরি ডেভি, জোসেফ লুইস গে-লুউসাক এবং লুই জ্যাকস টেনার দ্বারা পরিচালিত এই গবেষণার ফলস্বরূপ, এটি স্পষ্ট হয়ে উঠেছে যে ক্লোরিন অক্সিজেন ধারণ করে না এবং এটি একটি সহজ পদার্থ। উপরন্তু, পরীক্ষাগুলি গে-লুসস্কের পরীক্ষায় নেতৃত্ব দেয়, যা হাইড্রোজেনের ক্লোরিন প্রতিক্রিয়াগুলিতে গ্যাসের পরিমাণগত অনুপাত বিশ্লেষণ করে।
1811 সালে, গ্রিক থেকে ডেভির নাম "ক্লোরিন" নামটি প্রস্তাব করেছিলেন - গ্রিক থেকে। "ক্লোরোস" হলুদ সবুজ। এটি এমন একটি রঙ যা ক্লোরিন আছে। একই রুটটি "ক্লোরোফিল" শব্দটি (গ্রিক থেকে। "ক্লোরোস" এবং "ফিলন" - পাতা)। এক বছর পর, গে লুসাক ক্লোরিনের নামটি "কাটা"। কিন্তু এ পর্যন্ত ব্রিটিশ (এবং আমেরিকানরা) এই উপাদানটিকে "ক্লোরিন" (ক্লোরিন) বলা হয়, যখন ফরাসি ক্লোরিন (চ্লোর)। সংক্ষেপিত নাম এবং জার্মানদের গ্রহণ করুন - প্রায় 19 ভি। এর মধ্যে রসায়ন এর "আইন প্রণেতারা" গ্রহণ করুন। (জার্মান ক্লোরিন - ক্লোর)। 1811 সালে, জার্মান পদার্থবিজ্ঞানী জোহন Schweiher ক্লোরিনের জন্য "হ্যালোজেন" নামটি প্রস্তাব করেছিলেন (গ্রীক "হেলস" - লবণ এবং "জেনোও" - জন্মদান)। পরবর্তীতে, এই শব্দটি শুধুমাত্র ক্লোরিনের জন্য নয়, সপ্তম গোষ্ঠী অনুসারে - ফ্লোরিন, ব্রোমাইন, আইডিন, অ্যাসস্ট্যাটের অনুসারে তার সমস্ত এনালগগুলির জন্যও।
ক্লোরিনের বায়ুমণ্ডলে হাইড্রোজেন বার্নিংয়ের বিক্ষোভ আকর্ষণীয়: কখনও কখনও অভিজ্ঞতার সময় একটি অস্বাভাবিক পার্শ্ব প্রতিক্রিয়া ঘটে: একটি buzz শোনা হয়। প্রায়শই, পাতলা টিউব হাইড্রোজেন দ্বারা খাওয়ানো হয় যখন শিখা buzzing হয়, ক্লোরো দিয়ে ভরা শঙ্কু আকৃতি এর পাত্র মধ্যে নত হয়; একই গোলাকার flasks জন্য সত্য, কিন্তু সিলিন্ডার মধ্যে শিখা সাধারণত buzzing হয় না। এই ঘটনাটিকে "বপন শিখা" বলা হয়।
একটি জলের সমাধান, ক্লোরিন আংশিকভাবে এবং ধীরে ধীরে জল সঙ্গে প্রতিক্রিয়া হয়; ২5 ডিগ্রি সেলসিয়াসে, ভারসাম্য: সিএল 2 + \u200b\u200bএইচ 2 হে এইচসিএল + এইচসিএল দুই দিনের জন্য ইনস্টল করা হয়েছে। হালকা decomposes মধ্যে ক্লোরিন অ্যাসিড: HCLO ® HCL + O. এটি হোয়াইটাইজিং প্রভাব (একেবারে শুষ্ক ক্লোরিন যেমন ক্ষমতা ভোগ করে না।
তার যৌগের ক্লোরিন অক্সিডেশন এর সমস্ত ডিগ্রী প্রদর্শন করতে পারে - -1 থেকে +7 পর্যন্ত। ক্লোরিন অক্সিজেনের সাথে অক্সাইডগুলির একটি সিরিজ তৈরি করে, তারা সমস্ত বিশুদ্ধ আকারে অস্থির এবং বিস্ফোরক: CL 2 o হল হলুদ-কমলা গ্যাস, CLO 2 - হলুদ গ্যাস (9.7 ডিগ্রি সেলসিয়াস - উজ্জ্বল রঙের তরল), ক্লোরোরেট ক্লোরিন ক্লোরিন ক্লোরিন ক্লোরিন ক্লোরিন O 4 (CLO -CLO 3, হালকা হলুদ তরল), CL 2 O 6 (O 2 CL-O-Clo 3, উজ্জ্বল লাল তরল), CL 2 O 7 - বর্ণহীন খুব বিস্ফোরক তরল। কম তাপমাত্রায়, অস্থির CL 2 ও 3 এবং ক্লো 3 অক্সাইড প্রাপ্ত হয়েছিল। Clo 2 অক্সাইড একটি শিল্প স্কেলে উত্পাদিত হয় এবং সেলুলোজ bleaching এবং পানীয় জল এবং sewage নির্বীজন জন্য ক্লোরিন পরিবর্তে ব্যবহার করা হয়। অন্যান্য হ্যালোজেনের সাথে, ক্লোরিনের সাথে তথাকথিত ইন্টারংগেনেনজেনিক যৌগের সংখ্যা গঠন করে, উদাহরণস্বরূপ, সিএলএফ, ক্লিফ 3, ক্লিফ 5, ব্র্যাক, আইসিএল, আইসিএল 3।
ক্লোরিন এবং তার যৌগিক একটি ইতিবাচক ডিগ্রী অক্সিডেশন শক্তিশালী অক্সিডাইজার হয়। 18২২ সালে, জার্মান রসায়নবিদ লিওপোল্ড জিমেলিন হলুদ রক্ত \u200b\u200bথেকে ক্লোরিন oxidizing দ্বারা: 2k 4 + CL 2 ® কে 3 + 2kcl। ক্লোরিন সহজেই ব্রোমাইন এবং ক্লোরাইডগুলি ব্রোমাইন এবং আইডিনের মুক্ত ফর্মের সাথে অক্সিডাইস করে।
বিভিন্ন অক্সিডেশন ডিগ্রিগুলিতে ক্লোরিন অ্যাসিডের একটি সারি গঠন করে: এইচসিএল - ক্লোরাইড (লবণ, লবণ, লবণ - ক্লোরাইডস), এইচসিএলও 2 - ক্লোরাইড (লবণ - ক্লোরাইট), এইচএলএল 3 - ক্লোরু্যান্ট (লবণ - ক্লোরোজেস) , HCLO 4 - ক্লোরিন (লবণ - perchlorates)। অক্সিজেন অ্যাসিড এর বিশুদ্ধ আকারে, শুধুমাত্র ক্লোরিন স্থিতিশীল। অক্সিজেন অ্যাসিডের লবণ থেকে। প্র্যাকটিসাল অ্যাপ্লিকেশনগুলি হোয়াইটেন্সি, সোডিয়াম ক্লোরাইট NACLO 2 - অক্সিজেনের কম্প্যাক্ট পিরোটেকনিক উত্সগুলির জন্য, পটাসিয়াম ক্লোরেটস (বার্টোলেট লবণ), ক্যালসিয়াম এবং ম্যাগনেসিয়াম (কৃষি যুদ্ধের জন্য) কীটপতঙ্গ, পিরোটেকনিক রচনাগুলি এবং বিস্ফোরকগুলির উপাদানগুলি, ম্যাচ উত্পাদনগুলিতে), পারচ্লোরেটস - বিস্ফোরক এবং পিরোটেকনিক রচনাগুলির উপাদান; অ্যামোনিয়াম পারচ্লোরেট কঠিন রকেট জ্বালানী একটি উপাদান।
ক্লোরিন অনেক জৈব যৌগ সঙ্গে প্রতিক্রিয়া। এটি দ্রুত দ্বিগুণ এবং ট্রিপল কার্বন-কার্বন বন্ডগুলির সাথে অসন্তুষ্ট যৌগের সাথে যুক্ত করে (অ্যাস্টিলিনের প্রতিক্রিয়া একটি বিস্ফোরণের সাথে প্রতিক্রিয়া), এবং আলোর মধ্যে এবং বেনজিনের সাথে। নির্দিষ্ট অবস্থার অধীনে, ক্লোরিন জৈব যৌগগুলিতে হাইড্রোজেন পরমাণু প্রতিস্থাপন করতে পারেন: R-H + CL 2 ® RCL + HCL। এই প্রতিক্রিয়া জৈব রসায়ন ইতিহাসে একটি উল্লেখযোগ্য ভূমিকা পালন করে। 1840-এর দশকে, ফরাসি রসায়নবিদ জিন বাটিস্টে ডুমা আবিষ্কার করেছিলেন যে অ্যামেটিক অ্যাসিডের ক্লোরিনের অ্যাক্টের অধীনে একটি প্রতিক্রিয়া রয়েছে
CH 3 স্যাম + CL 2 ® সিএইচ 2 Clcooh + Hcl। ক্লোরিনের অতিরিক্ত পরিমাণে, ট্রিক্লোসেটিক এসিড এসএল 3 কক্সি গঠিত হয়। যাইহোক, অনেক রসায়নবিদ duma মধ্যে অবিশ্বাস্যভাবে প্রতিক্রিয়া। প্রকৃতপক্ষে, সাধারণত গৃহীত, বার্সেলিয়াসের তত্ত্ব, ইতিবাচকভাবে চার্জযুক্ত হাইড্রোজেন পরমাণুগুলি নেতিবাচকভাবে চার্জযুক্ত ক্লোরিন পরমাণু দ্বারা প্রতিস্থাপিত করা যায় না। এই মতামতটি সেই সময়ে অনেক অসাধারণ রসায়নবিদদের কাছে মেনে চলছিল, যাদের মধ্যে ফ্রেডরিচ ভোললার, ইয়াস্টাস লিবিহ এবং অবশ্যই, বার্সেলিয়াস নিজেই ছিলেন।
Dumas মজার করার জন্য, ভাইলার তার বন্ধু লিবিহা একটি নতুন সফল আবেদন সম্পর্কে একটি নতুন সফল আবেদন সম্পর্কে কিছু Schwindler (Schwindler - Schwindler - Schwindler - Schwindler - এর পক্ষে) একটি নিবন্ধ দিয়েছেন। নিবন্ধটিতে, একটি সুস্পষ্ট ট্র্যাপিংয়ের সাথে ভোলারটি কীভাবে অ্যাসেটিক অ্যাসিড ম্যাগানিজ এমএন (সিএইচ 3 সিওও) তে সব উপাদান পরিচালনা করে, তাদের মূল্যবোধ অনুযায়ী, ক্লোরিনের সাথে এটি প্রতিস্থাপন করে, যার ফলে ক্লোরিনের সাথে গঠিত একটি হলুদ স্ফটিন পদার্থ। বলা হয় যে ইংল্যান্ডে, জৈব যৌগগুলিতে জৈব যৌগগুলিতে ক্লোরিন পরমাণুতে সমস্ত পরমাণু, প্রচলিত টিস্যু ক্লোরিনে পরিণত হয় এবং এর ফলে, জিনিসগুলি তাদের চেহারা বজায় রাখে। পাদটীকা এটি বলেছিল যে লন্ডন কোট দোকানগুলি একটি ক্লোরিনের সাথে একটি উপাদান দ্বারা ট্রেড করা হয়, কারণ এই উপাদানটি রাতের ক্যাপ এবং উষ্ণ গুণাবলীগুলির জন্য খুব ভাল।
জৈব যৌগের সাথে ক্লোরিনের প্রতিক্রিয়াটি ক্লোরোজিক পণ্যগুলির একটি সেট গঠনের দিকে পরিচালিত করে, যার মধ্যে ব্যাপকভাবে মিথাইলিন ক্লোরাইড সিএইচ 2 টি ক্লোরি 2, ক্লোরোফর্ম CHCL 3, CCL চার ক্লোরাইড ক্লোরাইড, ট্রাইক্লোরিথিলিন CHCL \u003d CCL 2, TETRACHLORETHYLENEN CCL 2 CL 4। আর্দ্রতা উপস্থিতিতে, ক্লোরিন গাছের সবুজ পাতা, অনেক রঙের blews। এটি এখনো XVIII শতাব্দীতে ব্যবহৃত হয়েছিল। কাপড় whitening জন্য।
গ্যাস বিষাক্ত গ্যাস হিসাবে ক্লোরিন।
ক্লোরিন শেলেন তার খুব অপ্রীতিকর ধারালো গন্ধ উদযাপন, শ্বাস এবং কাশি অসুবিধা। পরে, ব্যক্তিটি ক্লোরিনের গন্ধ অনুভব করে, এমনকি যদি এক লিটার এই গ্যাসের মধ্যে মাত্র 0.005 মিগ্রা থাকে এবং একই সাথে শ্বাসযন্ত্রের একটি বিরক্তিকর প্রভাব থাকে, শ্বাসযন্ত্রের শ্বাসনালী ঝিল্লিটির কোষগুলি ধ্বংস করে ট্র্যাক্ট এবং ফুসফুস। 0.012 মিগ্রা / এল ঘনত্ব অসুবিধা সঙ্গে worn হয়; ক্লোরিনের ঘনত্ব 0.1 মিগ্রা / এল অতিক্রম করে তবে এটি হুমকি হয়ে উঠেছে: শ্বাস ব্যয়বহুল, হতাশ হয়ে পড়ে, এবং তারপরে সবকিছুই আরও বিরল, এবং 5-25 মিনিটের পরে শ্বাস নেয়। শিল্প সংস্থার বাতাসে সর্বাধিক অনুমতিযোগ্য 0.001 মিগ্রা / এল, এবং আবাসিক এলাকায় বাতাসে ঘনত্ব - 0.00003 মিগ্রা / এল।
পিটার্সবার্গে একাডেমিক ভাষা টোভি ইজোরোভিচ লোভিটস, 1790 সালে পুনরাবৃত্তি শেললেটির অভিজ্ঞতা, ঘটনাক্রমে বাতাসে একটি উল্লেখযোগ্য পরিমাণে ক্লোরিন একটি উল্লেখযোগ্য পরিমাণ প্রকাশ করে। এটি অনুপ্রেরণা, তিনি চেতনা হারিয়ে এবং পড়ে গিয়েছিলেন, তারপর আট দিনের জন্য তার বুকে বেদনাদায়ক ব্যথা ভোগ করে। সৌভাগ্যক্রমে, তিনি উদ্ধার। আমি প্রায় মারা গেছি, ক্লোরিন পৌঁছেছেন, এবং বিখ্যাত ইংরেজী রসায়নবিদ ডেভি। এমনকি ক্লোরিনের অল্প পরিমাণে পরীক্ষাগুলি বিপজ্জনক, কারণ তারা গুরুতর ফুসফুসের ক্ষতি হতে পারে। বলা হয় যে জার্মান রসায়নবিদ ইগা ভিবার্গ ক্লোরিনের উপর তাঁর বক্তৃতাগুলির মধ্যে একটি শব্দে শুরু হয়েছিল: "ক্লোরিন একটি বিষাক্ত গ্যাস। যদি আমি পরবর্তী বিক্ষোভের সময় ঢেলে দিই, তবে আমাকে দূরে নিয়ে যাও, দয়া করে, তাজা বাতাসে। কিন্তু একই সময়ে বক্তৃতাটিকে বাধা দিতে হবে। " আমরা যদি বাতাসে ক্লোরিন অনেক মুক্তি পাই তবে এটি একটি বাস্তব দুর্যোগ হয়ে যায়। এই প্রথম বিশ্বযুদ্ধের সময় অ্যাংলো-ফরাসি সৈন্যদের অভিজ্ঞতা লাভ করে। ২২ এপ্রিল, 1915 সালের ২২ এপ্রিল সকালে জার্মান কমান্ড যুদ্ধের ইতিহাসে প্রথম গ্যাস হামলা করার সিদ্ধান্ত নেয়: যখন বাতাসের দিকে বাতাসে বাতাসে বাতাসের প্রথম ছয় কিলোমিটার বিভাগে থাকে বেলজিয়ান শহর আইপিআর, 5730 সিলিন্ডার ভালভ একই সময়ে খোলা হয়েছিল, যার মধ্যে প্রতিটি 30 কেজি তরল ক্লোরিন রয়েছে। 5 মিনিটের মধ্যে, একটি বিশাল হলুদ-সবুজ মেঘ গঠিত হয়, যা ধীরে ধীরে জার্মানির দিকে জার্মানির ট্রেঞ্চ ছেড়ে চলে যায়। ব্রিটিশ ও ফরাসি সৈন্যরা সম্পূর্ণভাবে প্রতিরক্ষামূলক হয়ে উঠেছিল। গ্যাস সব আশ্রয়স্থল মধ্যে ফাটল penetrated, তার কাছ থেকে কোন পরিত্রাণ ছিল না: কারণ গ্যাস মাস্ক এখনও উদ্ভাবিত হয় নি। ফলস্বরূপ, 15 হাজার মানুষ বিষাক্ত, যার মধ্যে 5 হাজার মারা যায়। এক মাসে, 31 মে, জার্মানরা রাশিয়ান সৈন্যদের বিরুদ্ধে পূর্বের দিকে গ্যাসের আক্রমণকে পুনরাবৃত্তি করেছিল। এটা বলিমভ শহরে পোল্যান্ডে ঘটেছে। 1২ হাজার সিলিন্ডারের সামনে 1২ কিলোমিটার সিলিন্ডার, ২64 টন ক্লোরিন মিশ্রণে উল্লেখযোগ্যভাবে আরো বিষাক্ত ফসজিন (কয়লা অ্যাসিড ক্লোরাইড কোক্লি ২) মুক্তি পায়। রাজকীয় কমান্ড আইপিআর-এর সময় কী ঘটেছিল তা নিয়ে জানতেন এবং তবুও রাশিয়ান সৈন্যদের সুরক্ষা কোন উপায় ছিল না! গ্যাসের আক্রমণের ফলে, ক্ষতিটি 9146 জন মানুষের কাছে ছিল, যার মধ্যে মাত্র 108 টি রাইফেল এবং আর্টিলারি শেলিংয়ের ফলে বাকিটি বিষাক্ত ছিল। একই সময়ে, 1183 জন মানুষ প্রায় অবিলম্বে মারা যান।
শীঘ্রই রসায়নবিদরা ক্লোরিন থেকে পালাতে কীভাবে নির্দেশ করেছিলেন: সোডিয়াম থিওসফফেট সমাধানের সাথে impregnated একটি গজ ব্যান্ডেজের মাধ্যমে শ্বাস ফেলা প্রয়োজন (এই পদার্থটি ফটোতে ব্যবহৃত হয়, এটি প্রায়শই হিপোসুলফাইট বলা হয়)। ক্লোরিন খুব দ্রুত Thiosulfate একটি সমাধান সঙ্গে প্রতিক্রিয়া, এটি oxidizing:
NA 2 S 2 o 3 + 4CL 2 + 5H 2 O ® 2H 2 তাই 4 + 2NACL + 6HCL। অবশ্যই, সালফিউরিক অ্যাসিড এছাড়াও একটি ক্ষতিকারক পদার্থ নয়, তবে এর পাতলা জলীয় সমাধান বিষাক্ত ক্লোরিনের চেয়ে অনেক কম বিপজ্জনক। অতএব, সেই বছরগুলিতে থিওসফফেটটি আরেকটি নাম প্রকাশ করেছে - "Antichlor", কিন্তু প্রথম Thiosulfate গ্যাস মাস্কগুলি একটু কার্যকর ছিল।
1916 সালে, রাশিয়ান রসায়নবিদ, ভবিষ্যত একাডেমিক নিকোলাই দিমিতিভিচ জেলিনস্কি সত্যিই কার্যকরী গ্যাস মাস্ক আবিষ্কার করেছিলেন, যার মধ্যে অ্যাক্টিভেটেড কয়লা একটি স্তর দ্বারা বিষাক্ত পদার্থ আটক করা হয়েছিল। একটি খুব উন্নত পৃষ্ঠের সাথে যেমন কয়লা হাইপোসুলফাইটের সাথে impregnated গজ চেয়ে অনেক বেশি ক্লোরিন বিলম্ব হতে পারে। সৌভাগ্যক্রমে, "ক্লোরিন আক্রমণ" ইতিহাসে শুধুমাত্র একটি দুঃখজনক পর্ব ছিল। প্রথম বিশ্বযুদ্ধের পর ক্লোরিন শুধুমাত্র শান্তিপূর্ণ পেশাজীবী ছিল।
ক্লোরিন ব্যবহার।
প্রতি বছর, ক্লোরিনের বিপুল পরিমাণ - লক্ষ লক্ষ টন টেন। শুধুমাত্র মার্কিন যুক্তরাষ্ট্রে ২0 শতকের শেষ নাগাদ। প্রতি বছর, প্রায় 1২ মিলিয়ন টন ক্লোরিন ইলেক্ট্রোলিসিস দ্বারা প্রাপ্ত হয়েছিল (রাসায়নিক শিল্পের মধ্যে 10 তম স্থান)। তার প্রধান ভর (50% পর্যন্ত) জৈব যৌগের ক্লারিনেশন এবং সলভেন্টস, সিন্থেটিক রাবার, পলিভিনাইল ক্লোরাইড এবং অন্যান্য প্লাস্টিক, ক্লোরোপিন রাবার, কীটনাশক, ওষুধ, অন্যান্য প্রয়োজনীয় এবং দরকারী পণ্যগুলি অর্জনের জন্য জৈব যৌগের ক্লোরিনেশন ব্যয় করা হয়। বাকিরা জল পরিশোধনের জন্য কাঠের সজ্জা, কাঠের সজ্জা এবং কাগজের শিল্পে, পশম এবং কাগজের শিল্পে অজৈব ক্লোরাইডগুলির সংশ্লেষণের জন্য গ্রাস করা হয়। অপেক্ষাকৃত ছোট পরিমাণে, ক্লোরিন ধাতব শিল্পে ব্যবহৃত হয়। এর সাথে, খুব পরিষ্কার ধাতু পাওয়া যায় - টাইটানিয়াম, টিন, তান্তালুম, এনবিয়ামিয়াম। ক্লোরিনে হাইড্রোজেন জ্বলন্ত ক্লোরাইড দ্বারা প্রাপ্ত হয়, এবং হাইড্রোক্লোরিক অ্যাসিড এটি থেকে প্রাপ্ত হয়। ক্লোরিন এছাড়াও bleaching পদার্থ (hypochlorites, ক্লোরিন চুন) এবং ক্লোরিন সঙ্গে জল নির্বীজন উত্পাদন জন্য ব্যবহৃত হয়।
ইলিয়াস লেন্সন
প্রাপ্তির মূল শিল্প পদ্ধতি একটি ঘনীভূত nacl (Fig। 96)। একই সময়ে, এটি প্রকাশ করা হয় (2 এসএল '- 2E- \u003d CL 2), এবং ক্যাথোড স্পেসে (2N · + 2E - \u003d H 2) প্রকাশ করা হয় এবং নামগুলি তৈরি করে।
ল্যাবরেটরি অর্জনের সাথে সাধারণত MNO 2 বা KMNO 4 এর ক্রিয়াটি ব্যবহার করুন:
এমএনও 2 + 4NSL \u003d MNSL 2 + CL 2 + 2N 2
2KMNO 4 + 16NSL \u003d 2XL + 2MNSL 2 + 5SL 2 + 8H 2 ও
তার চরিত্রগত রাসায়নিক ফাংশন দ্বারা, এটি একটি সক্রিয় mativeent metalloid হয়। যাইহোক, এটা যে চেয়ে কম। অতএব, পরের যৌগ থেকে outpace করতে পারবেন।
সফ্টওয়্যার সঙ্গে মিথস্ক্রিয়া এইচ 2 + CL 2 \u003d 2HCL + 44 KCAL
স্বাভাবিক অবস্থার অধীনে, এটি অত্যন্ত ধীরে ধীরে নেয়, কিন্তু যখন মিশ্রণটি উত্তপ্ত হয় বা তার শক্তিশালী আলো (সরাসরি সূর্যালোক, জ্বলন্ত, ইত্যাদি) দ্বারা সংসর্গী হয়।
Nacl + এইচ 2 তাই 4 \u003d নাহো 4 + এইচসিএল
Nacl + নাহো 4 \u003d না 2 তাই 4 + HCL
তাদের মধ্যে প্রথমটি আংশিকভাবে স্বাভাবিক অবস্থার অধীনে আয় করে এবং কার্যত কম গরম করার লক্ষ্যে থাকে; দ্বিতীয় শুধুমাত্র উচ্চতর বাহিত হয়। প্রক্রিয়া জন্য, একটি যান্ত্রিক মহান কর্মক্ষমতা পরিবেশন করা।
CL 2 + H 2 O \u003d HCL + NOSL
একটি অস্থির সংযোগ হচ্ছে, নাক ধীরে ধীরে যেমন একটি পাতলা এমনকি decomposes। ক্লোরোটিক অ্যাসিড বলা হয়, বা। নাক নিজেই এবং এটি খুব শক্তিশালী।
এই অর্জন করার জন্য প্রতিক্রিয়া মিশ্রণ যোগ করার সবচেয়ে সহজ উপায়। যেহেতু এটি পাওয়া যায়, এটি ডানদিকে যুক্ত হবে। উদাহরণস্বরূপ, নাহে আছে:
CL 2 + এইচ 2 ও<–––> NOSL + HCL।
HOCL + NSL + 2NAOH ---\u003e NAOCL + NACL + 2H 2 ও
অথবা সাধারণভাবে:
CL 2 + 2NAOH ---\u003e NAOCL + NACL + N 2
সঙ্গে মিথস্ক্রিয়া ফলে, এটি ক্লোরোটি একটি মিশ্রণ সক্রিয় আউট, তাই, এটি সক্রিয় আউট। গঠন (") শক্তিশালী অক্সিডেটিভ বৈশিষ্ট্য আছে এবং ব্যাপকভাবে bleaching জন্য ব্যবহৃত হয় এবং।
1) নাক \u003d NSL + ও
2) 2'এসএল \u003d এইচ 2 O + SL 2
3) 3HOCL \u003d 2NCL + NSLO 3
এই সমস্ত প্রক্রিয়া একযোগে এগিয়ে যেতে সক্ষম, কিন্তু তাদের আপেক্ষিক গতি বিদ্যমান অবস্থার উপর ব্যাপকভাবে নির্ভরশীল। পরেরটি পরিবর্তন করে, নিশ্চিত করা সম্ভব যে রূপান্তরটি প্রায় এক দিকের দিকে পরিচালিত করবে।
সরাসরি সূর্যালোকের বিচ্ছেদের কর্মকাণ্ডের অধীনে তাদের প্রথমে যায়। এটি সহজে সংযুক্তির উপস্থিতিতেও প্রবাহিত হয় এবং কিছু (উদাহরণস্বরূপ, ")।
তৃতীয় ধরণের নাক বিচ্ছিন্নতা গরম হলে বিশেষ করে সহজ। অতএব, গরম কর্ম মোট সমীকরণ দ্বারা প্রকাশ করা হয়:
ZSL 2 + 6con \u003d KCLO 3 + 5XL + 3N 2 O 2
2xlo 3 + H 2 C 2 O 4 \u003d K 2 CO 3 + CO 2 + H 2 O + 2CLO 2
একটি সবুজ-হলুদ ডাই অক্সাইড গঠিত হয় (প্লেন - 59 ডিগ্রি সেলসিয়াস, টি। Kip। + 10 ডিগ্রি সেলসিয়াস)। ফ্রি ক্লো 2 কম প্রতিরোধী এবং সঙ্গে বিচ্ছেদ করতে পারবেন