Unutrašnja struktura metala i legura. Struktura metala. Dijagram stanja legura gvožđa i ugljenika
Pročitajte također
Pošaljite svoj dobar rad u bazu znanja je jednostavno. Koristite obrazac ispod
Studenti, postdiplomci, mladi naučnici koji koriste bazu znanja u svom studiranju i radu biće vam veoma zahvalni.
Objavljeno na http://www.allbest.ru/
Unutrašnja struktura metala i legura
1. Atomska struktura metala
2. Polimorfizam. Anizotropija
3. Struktura realnih kristala i defekti kristalne rešetke
1 . Atomska struktura metala
Metali su oduvijek zauzimali posebno mjesto u ogromnom spektru materijala poznatih čovjeku od pamtivijeka i koje je on naširoko koristio u svom životu i radu.
Potvrda tome: iu nazivima epoha (zlatno, srebrno, bronzano, gvozdeno doba), na koje su Grci podelili istoriju čovečanstva: i u arheološkim nalazima metalnih proizvoda (kovani bakarni nakit, poljoprivredni alat); te u širokoj upotrebi metala i legura u modernoj tehnologiji.
Razlog tome su posebna svojstva metala, koja ih povoljno razlikuju od drugih materijala i čine ih u mnogim slučajevima nezamjenjivim.
Metali su jedna od klasa konstrukcijskih materijala koju karakterizira određeni skup svojstava:
· "Metalni sjaj" (dobra refleksivnost);
· Plastičnost;
· Visoka toplotna provodljivost;
· Visoka električna provodljivost.
Ova svojstva su posljedica posebnosti strukture metala. Prema teoriji metalnog stanja, metal je supstanca koja se sastoji od pozitivnih jezgara, oko kojih se elektroni vrte u orbitalama. Na posljednjem nivou, broj elektrona je mali i oni su slabo vezani za jezgro. Ovi elektroni imaju sposobnost da se kreću po zapremini metala, tj. pripadaju čitavoj kolekciji atoma.
Dakle, plastičnost, toplotna provodljivost i električna provodljivost su obezbeđeni prisustvom "elektronskog gasa".
Svi metali koji se skrućuju u normalnim uvjetima su kristalne tvari, odnosno pakiranje atoma u njima karakterizira određeni red - periodičnost, kako u različitim smjerovima, tako iu različitim ravnima. Ovaj red je definisan konceptom kristalne rešetke.
Drugim riječima, kristalna rešetka je zamišljena prostorna rešetka u čijim se čvorovima nalaze čestice koje tvore čvrsti materijal.
Jedinična ćelija je element zapremine od minimalnog broja atoma čijim se višestrukim prenosom u prostoru može izgraditi ceo kristal.
Jedinična ćelija karakteriše karakteristike kristalne strukture. Glavni parametri kristala su:
Slika 1.1. Dijagram kristalne rešetke
dimenzije ivica jedinične ćelije. a, b, c - periodi rešetke - udaljenosti između centara najbližih atoma. U jednom pravcu, oni su strogo definisani.
uglovi između osa ().
koordinacijski broj (K) označava broj atoma koji se nalaze na najbližoj jednakoj udaljenosti od bilo kojeg atoma u rešetki.
osnova rešetke je broj atoma po jediničnoj ćeliji rešetke.
gustina pakiranja atoma u kristalnoj rešetki je volumen koji zauzimaju atomi, koji se konvencionalno smatraju krutim kuglicama. Definiše se kao omjer zapremine koju zauzimaju atomi i zapremine ćelije (za kubičnu rešetku centriranu na tijelo - 0,68, za kubičnu rešetku usmjerenu na lice - 0,74)
Klasifikaciju mogućih tipova kristalnih rešetki izvršio je francuski naučnik O. Bravet, odnosno nazvane su "Bravais rešetke". Postoji četrnaest tipova rešetki za kristalna tijela, podijeljenih u četiri tipa;
Rice. 1.2. Glavne vrste kristalnih rešetki: a - kubične sa centriranjem tijela; b - kubni centrirani; c - heksagonalno zbijeno
primitivno - čvorovi rešetke se poklapaju sa vrhovima jediničnih ćelija;
bazno-centrirano - atomi zauzimaju vrhove ćelija i dva mjesta na suprotnim stranama;
centriran na tijelo - atomi zauzimaju vrhove ćelije i njen centar;
lice centriran - atomi zauzimaju vrhove ćelije i centre svih šest lica
Glavne vrste kristalnih rešetki su:
1. Tijelo centriran kubik (BCC) (vidi sliku 1.2a), atomi se nalaze na vrhovima kocke iu njenom centru (V, W, Ti,)
2. Kubni centar sa licem (FCC) (vidi sliku 1.2b), atomi se nalaze na vrhovima kocke iu centru svake od 6 strana (Ag, Au,)
3. Šestougao, u čijoj osnovi je šestougao:
o jednostavno - atomi se nalaze na vrhovima ćelije iu centru 2 baze (ugljenik u obliku grafita);
o zbijeno (hcp) - postoje 3 dodatna atoma u srednjoj ravni (cink).
2 . Polimorfizam.Anizotropija
metalni kristalni atomski polimorfizam
Svojstva tijela zavise od prirode atoma od kojih se sastoji i od jačine interakcije između ovih atoma. Sile interakcije između atoma u velikoj mjeri su određene udaljenostima između njih. U amorfnim tijelima s haotičnim rasporedom atoma u prostoru, udaljenosti između atoma u različitim smjerovima su jednake, stoga će svojstva biti ista, odnosno amorfna tijela su izotropna.
U kristalnim tijelima atomi su pravilno locirani u prostoru, a u različitim smjerovima udaljenosti između atoma nisu iste, što predodređuje značajne razlike u silama interakcije među njima i, u krajnjem rezultatu, različita svojstva. Ovisnost svojstava o smjeru naziva se anizotropija.
Da bi se razumio fenomen anizotropije, potrebno je razlikovati kristalografske ravni i kristalografske pravce u kristalu.
Ravan koja prolazi kroz čvorove kristalne rešetke naziva se kristalografska ravan.
Prava linija koja prolazi kroz čvorove kristalne rešetke naziva se kristalografski pravac.
Millerovi indeksi se koriste za označavanje kristalografskih ravni i pravaca. Za postavljanje Millerovih indeksa, jedinična ćelija se upisuje u prostorni koordinatni sistem (X, Y, Z ose su kristalografske ose). Jedinica mjere je period rešetke.
Slika 1.3. Primjeri označavanja kristalografskih ravnina (a) i kristalografskih pravaca (b)
Za određivanje indeksa kristalografske kristalografske ravni potrebno je:
postaviti koordinate tačaka preseka ravnine sa koordinatnim osama u jedinicama perioda rešetke;
uzeti recipročnu vrijednost ovih vrijednosti;
svesti ih na najmanji cjelobrojni višekratnik, svaki od dobijenih brojeva.
Dobijene vrijednosti prostih cijelih brojeva, koji nemaju zajednički faktor, su Millerovi indeksi za ravan, naznačeni u zagradama. Primjeri označavanja kristalografskih ravnina na sl. 1.3 a.
Drugim riječima, indeks osi pokazuje koliko dijelova ravan dijeli aksijalnu jedinicu duž date ose. Ravnine paralelne osi imaju indeks 0 (110)
Orijentacija prave linije određena je koordinatama dvije tačke. Za određivanje indeksa kristalografskog smjera potrebno je:
Poravnajte jednu tačku smjera s ishodištem koordinata;
postavite koordinate bilo koje druge tačke koja leži na pravoj liniji, u jedinicama perioda rešetke
dovesti omjer ovih koordinata do omjera tri najmanja cijela broja.
Indeksi kristalografskih pravaca navedeni su u uglastim zagradama.
U kubičnoj rešetki, indeksi pravca okomitog na ravan (hkl) imaju iste indekse.
Sposobnost nekih metala da postoje u različitim kristalnim oblicima u zavisnosti od spoljašnjih uslova (pritisak, temperatura) naziva se alotropija ili polimorfizam.
Svaki tip rešetke je alotropska modifikacija ili modifikacija.
Primjer alotropske modifikacije s temperaturom je željezo (Fe).
Fe: - bcc -;
OCC -; (visoke temperature)
Transformacija jedne modifikacije u drugu odvija se na konstantnoj temperaturi i praćena je termičkim efektom. Modifikacije elementa su označene slovima grčke abecede u obliku indeksa na glavnoj oznaci metala.
Primjer alotropske modifikacije zbog promjene tlaka je ugljik: pri niskim pritiscima nastaje grafit, a pri visokim pritiscima dijamant.
Koristeći fenomen polimorfizma, moguće je stvrdnjavanje i omekšavanje legura toplinskom obradom.
3 . Struktura stvarnih kristala i defekti kristalne rešetke
Pojedinačni kristal se može uzgajati iz tečnog rastapa. Obično se koriste u laboratorijama za proučavanje svojstava tvari.
Metali i legure dobijeni u normalnim uslovima sastoje se od velikog broja kristala, odnosno imaju polikristalnu strukturu. Ovi kristali se zovu zrna. Imaju nepravilan oblik i različito su orijentisani u prostoru. Svako zrno ima svoju orijentaciju kristalne rešetke, koja se razlikuje od orijentacije susjednih zrna, zbog čega su svojstva pravih metala usrednjena, a fenomen anizotropije se ne opaža. U kristalnoj rešetki pravih metala postoje različiti defekti (nesavršenosti) koji prekidaju veze između atoma i utiču na svojstva metala. Razlikuju se sljedeće strukturne nesavršenosti:
· Tačka - mala u sve tri dimenzije;
· Linearni - mali u dvije dimenzije i proizvoljno proširen u trećoj;
· Površno - malo u jednoj dimenziji.
Okrenuti defekti
Jedna od najčešćih nesavršenosti u kristalnoj strukturi je prisustvo točkastih defekata: praznine, dislocirani atomi i nečistoće. (sl. 2.1.)
Slika 2.1. Tačkasti defekti
Prazno mjesto - odsustvo atoma u čvorovima kristalne rešetke, "rupe" koje su nastale kao rezultat različitih razloga. Nastaje prilikom prelaska atoma s površine u okolinu ili sa mjesta rešetke na površinu (granice zrna, šupljine, pukotine, itd.), kao rezultat plastične deformacije, kada je tijelo bombardirano visokoenergetskim atomima. ili čestice (zračenje u ciklotronu ili neutronsko zračenje u nuklearnom reaktoru). Koncentracija slobodnih mjesta u velikoj mjeri je određena temperaturom tijela. Krećući se kroz kristal, mogu se sastati pojedinačna slobodna mjesta. I ujedinite se u divanci. Akumulacija mnogih slobodnih mjesta može dovesti do stvaranja pora i šupljina.
Dislocirani atom je atom koji je izašao iz mjesta rešetke i zauzeo mjesto u međuprostornom mjestu. Koncentracija dislociranih atoma je mnogo niža od koncentracije slobodnih mjesta, jer njihovo formiranje zahtijeva značajnu potrošnju energije. U tom slučaju na mjestu pomaknutog atoma formira se praznina.
Atomi nečistoće su uvijek prisutni u metalu, jer je gotovo nemoguće istopiti kemijski čist metal. Oni mogu biti veći ili manji od osnovnih atoma i nalaze se na mjestima rešetke ili međuprostorima.
Tačkasti defekti uzrokuju neznatna izobličenja rešetke, što može dovesti do promjene svojstava tijela (električna provodljivost, magnetna svojstva), njihovo prisustvo doprinosi procesima difuzije i faznim transformacijama u čvrstom stanju. Dok se kreću kroz materijal, defekti mogu stupiti u interakciju.
Linearni defekti:
Dislokacije su glavni linearni defekti. A priori koncept dislokacija prvi put su upotrijebili Orowan i Teyler 1934. godine u svom proučavanju plastične deformacije kristalnih materijala kako bi objasnili veliku razliku između praktične i teorijske čvrstoće metala.
Dislokacija su defekti kristalne strukture, a to su linije, duž i blizu kojih je narušen ispravan raspored atomskih ravni karakterističnih za kristal.
Najjednostavniji tipovi dislokacija su rubne i vijčane.
Rubna dislokacija je linija duž koje se ivica “dodatne” poluravnine lomi unutar kristala (slika 2.2)
Rice. 2.2. Rubna dislokacija (a) i mehanizam njenog nastanka (b)
Nepotpuna ravan se naziva ekstra ravan.
Većina dislokacija nastaje mehanizmom smicanja. Njegovo formiranje može se opisati sljedećom operacijom. Kristal prerežite duž ABCD ravni, pomjerite donji dio u odnosu na gornji jedan po jedan period rešetke u smjeru okomitom na AB, a zatim ponovo spojite atome na rubovima reza na dnu.
Najveća izobličenja u rasporedu atoma u kristalu dešavaju se blizu donje ivice ekstraravnine. Desno i lijevo od ruba ekstraravnine, ova izobličenja su mala (nekoliko perioda rešetke), a duž ruba ekstraravnine izobličenja se protežu kroz cijeli kristal i mogu biti vrlo velika (hiljade perioda rešetke) (Sl. 2.3).
Ako je ekstraravnina u gornjem dijelu kristala, tada je dislokacija ruba pozitivna (), ako je u donjem dijelu, onda je negativna (). Dislokacije istog znaka odbijaju, a suprotne privlače.
Rice. 2.3. Distorzije u kristalnoj rešetki u prisustvu dislokacije ruba
Drugu vrstu dislokacije opisao je Burgers i dobila je naziv vijčana dislokacija
Vijčana dislokacija se dobija delimičnim smicanjem duž Q ravni oko EF linije (slika 2.4) Na površini kristala se formira stepenica koja prolazi od tačke E do ivice kristala. Takav parcijalni pomak narušava paralelizam atomskih slojeva, kristal se transformira u jednu atomsku ravan uvijenu u vijak u obliku šupljeg helikoida oko EF linije, koja predstavlja granicu koja razdvaja dio ravni klizanja, gdje je pomak već nastupila, od dijela gdje smjena nije počela. Makroskopski karakter područja nesavršenosti uočava se duž EF linije, au ostalim pravcima njegove dimenzije su nekoliko perioda.
Ako se prijelaz s gornjih horizonata na donje vrši okretanjem u smjeru kazaljke na satu, onda je dislokacija desna, a ako okretanjem suprotno od kazaljke na satu, lijeva.
Rice. 2.4. Mehanizam nastanka vijčane dislokacije
Vijčana dislokacija nije povezana ni sa jednom ravninom klizanja; može se kretati duž bilo koje ravnine koja prolazi kroz dislokacijske linije. Praznine i dislocirani atomi ne teku do vijčane dislokacije.
U procesu kristalizacije, atomi tvari koji precipitiraju iz pare ili otopine lako se vežu za stepenicu, što dovodi do spiralnog mehanizma rasta kristala.
Dislokacijske linije se ne mogu odsjeći unutar kristala; one se moraju ili zatvoriti, tvoreći petlju, ili se razgranati u nekoliko dislokacija, ili izaći na površinu kristala.
Dislokacionu strukturu materijala karakteriše gustina dislokacija.
Gustoća dislokacija u kristalu definira se kao prosječan broj dislokacijskih linija koje prelaze površinu od 1 m2 unutar tijela, ili kao ukupna dužina dislokacijskih linija u zapremini od 1 m3
(cm -2; m -2)
Gustoća dislokacije uvelike varira i ovisi o stanju materijala. Nakon pažljivog žarenja, gustina dislokacije je 10 5 ... 10 7 m -2, u kristalima sa jako deformiranom kristalnom rešetkom, gustina dislokacija dostiže 10 15 ... 10 16 m -2.
Gustoća dislokacije u velikoj mjeri određuje plastičnost i čvrstoću materijala (slika 2.5)
Rice. 2.5. Utjecaj gustine dislokacije na čvrstoću
Minimalna čvrstoća je određena kritičnom gustinom dislokacije
Ako je gustoća manja od vrijednosti a, tada se otpor na deformaciju naglo povećava, a čvrstoća se približava teorijskoj. Povećanje čvrstoće postiže se stvaranjem metala sa strukturom bez defekata, kao i povećanjem gustoće dislokacija, što otežava njihovo kretanje. Trenutno su stvoreni kristali bez defekata - brkovi dužine do 2 mm, debljine 0,5 ... 20 µm - "brkovi" čvrstoće blizu teorijske: za željezo = 13000 MPa, za bakar = 30000 MPa. Prilikom ojačavanja metala povećanjem gustine dislokacija ne bi trebalo da prelazi vrednosti od 10 15 ... 10 16 m -2. U suprotnom će se formirati pukotine.
Dislokacije utiču ne samo na čvrstoću i plastičnost, već i na druga svojstva kristala. S povećanjem gustoće dislokacija, unutarnja se povećava, optička svojstva se mijenjaju, a električni otpor metala raste. Dislokacije povećavaju prosječnu brzinu difuzije u kristalu, ubrzavaju starenje i druge procese te smanjuju kemijsku otpornost, pa se kao rezultat tretiranja površine kristala posebnim supstancama formiraju rupice na mjestima na kojima nastaju dislokacije.
Dislokacije se formiraju prilikom formiranja kristala iz rastopljene ili gasovite faze, tokom međusobnog rasta blokova sa malim uglovima dezorijentacije. Kada se prazna mjesta kreću unutar kristala, oni se koncentrišu, formirajući šupljine u obliku diskova. Ako su takvi diskovi veliki, onda ih je energetski povoljno "urušiti" formiranjem rubne dislokacije duž ruba diska. Dislokacije nastaju tokom deformacije, tokom kristalizacije, tokom termičke obrade.
Površinski defekti - granice zrna, fragmenti i blokovi (slika 2.6).
Rice. 2.6. Pogrešna orijentacija zrna i blokova u metalu
Veličine zrna su do 1000 mikrona. Uglovi dezorijentacije su do nekoliko desetina stepeni ().
Granica zrna je tanka površinska zona od 5 - 10 atomskih promjera s maksimalnim kršenjem reda u rasporedu atoma.
Struktura prijelaznog sloja potiče nakupljanje dislokacija u njemu. Na granicama zrna povećava se koncentracija nečistoća, što smanjuje površinsku energiju. Međutim, čak i unutar zrna, idealna struktura kristalne rešetke se nikada ne opaža. Postoje oblasti koje su pogrešno orijentisane jedna prema drugoj za nekoliko stepeni (). Ova područja se nazivaju fragmenti. Proces podjele zrna na fragmente naziva se fragmentacija ili poligonizacija.
Zauzvrat, svaki fragment se sastoji od blokova veličine manje od 10 μm, pogrešno orijentiranih pod kutom manjim od jednog stupnja (). Ova struktura se naziva blok ili mozaik.
Objavljeno na Allbest.ru
Slični dokumenti
Glavne vrste rešetki, točkasti i linijski defekti. Odnos između strukture kristalne rešetke i mehaničkih i fizičkih svojstava materijala. Realna struktura kristala, oblici plastične deformacije. Svojstva metala koji se koriste u građevinarstvu.
sažetak, dodan 30.07.2014
Klasifikacija defekata kristalne rešetke u metalima. Dijagram točkastih defekata u kristalu. Dislokacija kristalizacijom ili smicanjem. Raspored atoma u području vijčane dislokacije. Površinski ili 2D defekti. Dijagram strukture blokova.
predavanje, dodano 08.08.2009
Pravci i faze istraživanja u oblasti strukture i svojstava metala, njihov odraz u radovima domaćih i stranih naučnika različitih epoha. Vrste kristalnih rešetki metala, principi njihovog formiranja. Osnovna fizička i hemijska svojstva legura.
prezentacija dodana 29.09.2013
Tačkasti defekti u kristalnoj rešetki pravih metala: praznine, dislocirani atomi i nečistoće. Formiranje linearnih defekata (dislokacija). Uloga vijčane dislokacije u formiranju rastućeg kristala. Utjecaj gustine dislokacije na čvrstoću.
prezentacija dodata 14.10.2013
Karakterizacija hemijskih i fizičkih svojstava metala. Omjer metala i oksidansa - jednostavne tvari. Fizičko značenje unutrašnjeg trenja materijala. Primjeri primjene metode unutrašnjeg trenja u metalurgiji. Potražite dinamički modul.
seminarski rad dodan 30.10.2014
Svojstva i atomsko-kristalna struktura metala. Energetski uslovi procesa kristalizacije. Struktura metalnog ingota. Proučavanje odnosa između svojstava legura i vrste faznog dijagrama. Komponente i faze legura gvožđa i ugljenika.
seminarski rad dodan 03.07.2015
Obilje metala u prirodi. Sadržaj metala u zemljinoj kori u slobodnom stanju iu obliku legura. Klasifikacija oblasti savremene metalurgije u zavisnosti od metoda vađenja metala. Karakteristike metalurških procesa.
prezentacija dodata 19.02.2015
Klasifikacija metala prema glavnoj komponenti, prema tački topljenja. Karakteristične karakteristike koje razlikuju metale od nemetala: vanjski sjaj, visoka čvrstoća. Karakteristične karakteristike crnih i obojenih metala. Analiza legura obojenih metala.
test, dodano 04.08.2012
Određivanje mehaničkih svojstava konstrukcijskih materijala ispitivanjem zatezanja. Metode za proučavanje kvaliteta, strukture i svojstava metala i legura, određivanje njihove tvrdoće. Termička obrada kovanih aluminijskih legura.
tutorial, dodano 29.01.2011
Suština i svrha termičke obrade metala, postupak i pravila za njegovu provedbu, sorte i karakteristične karakteristike. Termomehanička obrada kao nova metoda kaljenja metala i legura. Svrhe hemijsko-termičke obrade metala.
Većina legura se dobija spajanjem komponenti u tečnom stanju. Komponente koje čine legure u čvrstom stanju mogu međusobno komunicirati na različite načine, formirajući mehaničke smjese, čvrste otopine i kemijska jedinjenja.
Mehanička mješavina dvije komponente nastaje kada se one ne rastvaraju jedna u drugoj u čvrstom stanju i ne ulaze u kemijsku interakciju. Legure – mehaničke mješavine (npr. olovo – antimon, kalaj – cink) su po svojoj strukturi heterogene i predstavljaju mješavinu kristala ovih komponenti. Istovremeno, kristali svake komponente u leguri u potpunosti zadržavaju svoja individualna svojstva. Zbog toga se svojstva takvih legura (npr. električni otpor, tvrdoća itd.) određuju kao aritmetička sredina vrijednosti svojstava obje komponente.
Legure - čvrste otopine karakteriziraju formiranje zajedničke prostorne kristalne rešetke od atoma osnovnog metala-otapala i atoma topivog elementa. Struktura takvih legura sastoji se od homogenih kristalnih zrna, poput čistog metala. Postoje supstituciona čvrsta rastvora (bakar-nikl, gvožđe-hrom i druge legure) i intersticijska čvrsta rastvora (na primer rastvor gvožđa i ugljenika) (slika 5).
Legure - čvrste otopine su najčešće. Njihova svojstva se razlikuju od svojstava sastavnih komponenti. Tako je, na primjer, tvrdoća i električna otpornost čvrstih otopina znatno veća nego kod čistih komponenti. Zbog svoje visoke duktilnosti, pogodni su za kovanje i druge vrste obrade pod pritiskom. Obradivost čvrstih rastvora je niska.
Hemijska jedinjenja, poput čvrstih rastvora, su homogene legure. Njihova važna karakteristika je da se tokom skrućivanja formira potpuno nova kristalna rešetka, koja se razlikuje od rešetki komponenti koje čine leguru. Dakle, svojstva hemijskog jedinjenja su nezavisna i ne zavise od svojstava komponenti. Hemijska jedinjenja se formiraju u strogo definisanom kvantitativnom odnosu legiranih komponenti. Sastav legure hemijskog jedinjenja izražava se hemijskom formulom. Ove legure obično imaju visoku električnu otpornost, visoku tvrdoću i nisku duktilnost. Dakle, hemijsko jedinjenje gvožđa sa ugljenikom – cementit (Fe 3 C) je 10 puta tvrđe od čistog gvožđa.
Kristalizacija legura
Legure imaju složeniju strukturu od jednostavnih metala. U tom smislu, procesi kristalizacije legura su mnogo složeniji od procesa kristalizacije metala.
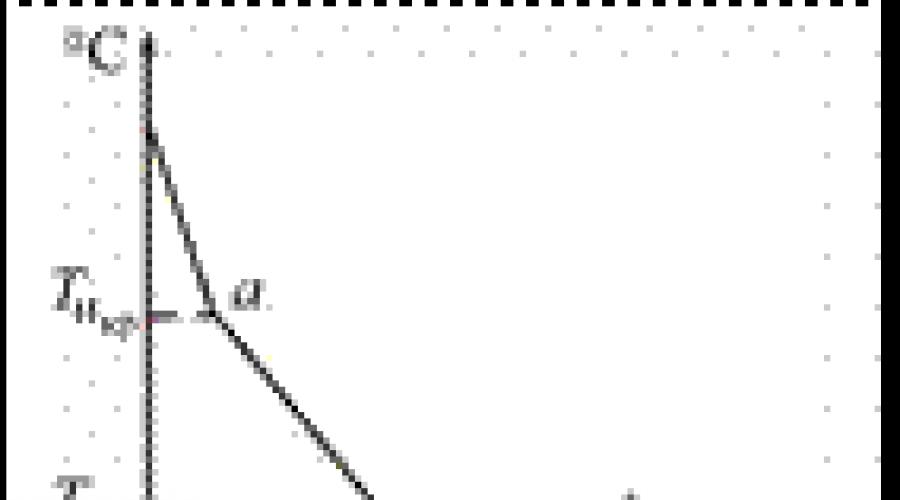
Legure, za razliku od čistih metala, tokom skrućivanja ili topljenja imaju ne jednu, već dvije kritične tačke - temperature, pri  koje se transformacije odvijaju u metalima ili legurama (slika 6).
koje se transformacije odvijaju u metalima ili legurama (slika 6).
Da bi se olakšalo proučavanje legura, one se kombinuju u sisteme.
Sistemi obuhvataju sve one legure koje se sastoje od istih komponenti i koje se međusobno razlikuju samo po kvantitativnom odnosu ovih komponenti, odnosno koncentraciji. Tako, na primjer, sve legure koje se sastoje od olova i antimona i koje se međusobno razlikuju samo po kvantitativnom sastavu ovih komponenti pripadaju sistemu legure olovo-antimon.
Broj legura jednog sistema, ali različitih koncentracija, toliki je da je praktično nemoguće proučiti sve transformacije koje se dešavaju u svakom od njih sa krivulja hlađenja ili grijanja, i to je neracionalno. Za proučavanje stanja legura odabranog sistema, u zavisnosti od temperature i koncentracije, gradi se dijagram stanja.
Unutrašnja struktura metala naziva se struktura i međusobni raspored njihovih atoma, kao i veća struktura vidljiva pod mikroskopom ili golim okom.
Metali u svojoj unutrašnjoj strukturi su kombinacija neutralnih atoma, pozitivno ili negativno nabijenih jona i slobodnih elektrona, koji tvore takozvani "elektronski plin". Prisustvo "elektronskog gasa" određuje visoku električnu i toplotnu provodljivost metala, a međusobno povezivanje slobodnih elektrona međusobno i sa ionima stvara jaku vezu koja se naziva metalna. Specifičnost metalne veze čini metale duktilnim (savitljivim).
Osim prirode atoma, na svojstva metala utječe i priroda veze između atoma, udaljenost između njih i redoslijed njihovog rasporeda.
Svi metali u čvrstom stanju imaju kristalnu strukturu, tj. njihovi atomi (joni) su raspoređeni u strogom, periodično ponavljajućem redosledu, formirajući atomsko-kristalnu rešetku u prostoru (za razliku od amorfnih čvrstih tela, čiji se atomi nalaze haotično u prostoru).
Redoslijed rasporeda atoma u različitim metalima nije isti. Obično se određuje jednostavnom karakteristikom za većinu metala (slika 6) ili složenim kristalnim rešetkama. Linije na sl. 6 konvencionalnih atoma zapravo vibrira oko ravnotežnih pozicija, odnosno na čvorovima kristalne rešetke. Udaljenost između atoma u kristalnoj rešetki mjeri se u angstromima (1 Å = 10 -9 nm). Za većinu metala, razmak između atoma je unutar 0,28-0,8 nm.


Slika 6. Redoslijed rasporeda atoma u jednostavnim rešetkamaa- obimanja samcentriran kubik (9 atoma), b - kubni centar sa licem (14 atoma), c - heksagonalni zbijeni (17 atoma)
Najmanji volumen kristala koji daje predstavu o atomskoj strukturi metala u cijelom volumenu naziva se elementarne kristalne ćelije.
Metali dobijeni na uobičajeni način su polikristalna tijela, koja se sastoje od mnogih jediničnih ćelija orijentiranih jedna prema drugoj na različite načine. Ćelije su nepravilnog oblika i nazivaju se kristaliti ili zrnca. Ako je kombinacija jediničnih ćelija ispravna, ponavljajući jediničnu ćeliju u rasporedu atoma, tada se rezultirajuće tijelo naziva monokristal.
Metalne legure, kao i metali, imaju kristalnu strukturu. Štaviše, u zavisnosti od interakcije komponenti, dele se na čvrste rastvore, hemijska jedinjenja i mehaničke mešavine.
Čvrste otopine nastaju kada, tokom fuzije, atomi jednog elementa u različitim količinama uđu u kristalnu rešetku drugog elementa, bez značajnog mijenjanja oblika. Element koji je zadržao oblik svoje rešetke naziva se rastvarač, a element čiji su atomi ušli u ovu rešetku naziva se otopljenim. Prema rasporedu atoma otopljenog elementa u rešetki rastvarača razlikuju se supstitucionih čvrstih rastvora(atomi otopljenog elementa nalaze se na mjestima rešetke rastvarača) i čvrsti rastvori za uvod(atomi otopljenog elementa nalaze se između atoma rastvarača i čvorova njegove rešetke).
Ako komponente supstitucionog čvrstog rastvora imaju sličnu strukturu rešetki i atoma, onda takvi elementi mogu formirati neprekidan niz čvrstih rastvora, tj. broj supstituisanih atoma može varirati od 0 do 100%.
Smatra se da je rastvarač element čiji je sadržaj u leguri veći od 50%.
Intersticijska rješenja formiraju elementi s vrlo različitim strukturama rešetke i atomskim veličinama.
Čvrste otopine su homogene (homogene) legure, jer im je struktura identična po sastavu i svojstvima zrna. Osobine čvrstih rastvora mogu se značajno razlikovati od svojstava njegovih sastavnih komponenti. Svi metali u jednom ili drugom stepenu mogu se rastvoriti jedan u drugom, formirajući čvrste rastvore.
Hemijska jedinjenja nastaju tokom hemijske interakcije atoma komponenti legure, praćene značajnim toplotnim efektom. U ovom slučaju, kristalna rešetka kemijskog spoja i sva njegova svojstva mogu se oštro razlikovati od rešetke i svojstava komponenti. Za razliku od čvrstih rastvora, hemijska jedinjenja se obično formiraju između komponenti koje imaju veliku razliku u elektronskoj strukturi atoma. Tipični primeri hemijskih jedinjenja su jedinjenja magnezijuma sa kalajem, olovom, antimonom, bizmutom, sumporom, selenom, telurom itd. Oni su homogene strukture.
Hemijska jedinjenja metala se nazivaju intermetalni(intermetalna jedinjenja) i jedinjenja metala sa nemetalima (nitridi, hidridi, boridi, karbidi), koji imaju metalnu vezu, - metalne veze.
Mehaničke mješavine nastaju kada se tokom skrućivanja taline atomi njegovih komponenti ne miješaju, već kristaliziraju u rešetku karakterističnu za svaku. Struktura takvih legura je heterogena (nehomogena) i predstavlja mješavinu kristala komponenti legure koje su zadržale svoju strukturu.

Rice. 7. Krive hlađenja amorfnih ( a), kristalno tijelo (b) i metali (v), gdje t do t n - temperatura kristalizacije i hipotermije, °C; (T 1 -T 2) - vrijeme kristalizacije, s.
Struktura kristalnog tijela određuje sljedeća posebna svojstva u poređenju s amorfnim:
§ razlika u svojstvima monokristala u različitim pravcima, odnosno anizotropija, ili vektoralnost, svojstava;
§ prisustvo ravni klizanja, primena spoljnih sila dovodi do klizanja (pomeranja) jedne ravni u odnosu na drugu;
§ postojanje kritične temperature tokom skrućivanja ili topljenja, pri kojoj dolazi do prelaska iz tečnog (rastopljenog) stanja u čvrsto ili obrnuto.
Prelazak metala iz tekućeg u čvrsto stanje naziva se kristalizacija, a iz čvrstog u tekuće stanje naziva se topljenje. Ako se formiranje kristala događa iz tekućine kada se ohladi, tada se ovaj proces naziva primarna kristalizacija, ako se formiranje kristala događa u čvrstom stanju tijela, naziva se sekundarna kristalizacija.
Procesi kristalizacije su grafički prikazani krivuljama ucrtanim u temperaturno-vremenskim koordinatama (slika 7).
Fenomen prehlađenja u kristalizirajućem metalu objašnjava se činjenicom da tokom perioda skrućivanja dolazi do naglog smanjenja pokretljivosti atoma, zbog čega se njegova unutrašnja energija naglo mijenja. Ovo je praćeno stvaranjem toplote, koja zagrijava tečnu kupku i to neko vrijeme (T 1-T 2) održava konstantnu temperaturu sve dok tečnost potpuno ne kristalizuje.
Što je veća brzina hlađenja, to je veći stepen hipotermije.
Ruski metalurški naučnik DK Černov je 1878. godine ustanovio da se proces kristalizacije sastoji od nekoliko faza. Prva faza je formiranje jezgara (centra) kristalizacije. U kasnijim fazama iz ovih centara nastaju dendriti (tvorbe nalik drvetu), koji, rastući zajedno, formiraju zrna (kristalite). Istovremeno, nemaju ispravan geometrijski oblik, jer se rast lica zaustavlja na mjestima kontakta rastućih kristala.
Veličina zrna metala je najvažnija karakteristika koja određuje sva njegova glavna svojstva. Fino zrni metal ima veće karakteristike tvrdoće, čvrstoće, udarne čvrstoće, ali ima smanjenu električnu provodljivost, lošije magnetne osobine.
Veličina zrna zavisi od broja kristalizacionih centara i brzine rasta kristala (brzine hlađenja). Što je više centara kristalizacije i što je niža brzina njihovog rasta, to će zrno biti manje.
Do stvaranja centara kristalizacije može doći spontano ili na česticama nečistoća prisutnim u tekućem metalu, što se koristi kada modificiranje- unošenje nečistoća (modifikatora) u tečni metal.
Na formiranje centara kristalizacije, a samim tim i na veličinu zrna utiče stepen hipotermije t do -t p... Što je veći stepen prehlađenja, to je više centara kristalizacije i dobijeno zrno je finije.
Tagovi:
Unutrašnja struktura metala i legura
Sve čvrste materije se dele na amorfne i kristalne. U amorfnim tijelima atomi su raspoređeni haotično, odnosno neuređeno, bez ikakvog sistema (npr. staklo, ljepilo, vosak, kolofonij itd.). Svi metali i legure imaju kristalnu strukturu, odnosno atomi su raspoređeni u strogo određenom redoslijedu, s određenim geometrijskim uzorkom. (Kristalna tijela također uključuju kuhinjsku so, kvarc, granulirani šećer, itd.)
Ako su atomi metala mentalno povezani pravim linijama, tada će se dobiti ispravan geometrijski sistem, nazvan prostorna kristalna rešetka. Iz kristalne rešetke možete odabrati elementarnu kristalnu ćeliju, koja je najmanji kompleks atoma, ponavljanjem koje u tri dimenzije možete izgraditi cijelu rešetku.
Najčešća su tri tipa elementarnih kristalnih ćelija metala (slika 3): kubične telocentrirane (hrom, volfram, molibden, gvožđe (do 910° i od 1400 do 1539°C), titanijum (na temperaturama iznad 882°C). ° C), kubični centrirani (aluminij, bakar, nikl, olovo, zlato, srebro, željezo (na 910–1400 ° C)) i heksagonalni (cink, magnezij, berilijum, titan (do 882 ° C)) .
Atomi metala formiraju kristalne rešetke zbog prisustva posebne metalne veze. U čvorovima kristalne rešetke metala nalaze se pozitivno nabijeni ioni, koji se drže na određenoj udaljenosti jedan od drugog slobodnim elektronima. Ova unutrašnja struktura određuje karakteristične karakteristike metala, kao što su električna i toplotna provodljivost, plastičnost. Svojstva metala ne zavise samo od vrste kristalne rešetke, već i od udaljenosti između atoma.
Geometrijska ispravnost rasporeda atoma u kristalnim rešetkama daje metalima osobine koje nemaju amorfna tijela.
Prva karakteristika metala je anizotropija svojstava kristala, odnosno razlika u svojstvima kristala u različitim smjerovima. Anizotropija se objašnjava nejednakom gustoćom atoma u različitim ravnima kristalne rešetke, budući da udaljenosti između atoma u rešetkama u različitim smjerovima nisu iste. Za razliku od kristalnih tijela, amorfna tijela su izotropna, odnosno njihova svojstva ne zavise od smjera.
U metalnim tijelima anizotropija svojstava nije tako izražena kao u pojedinačnim kristalima. Metali su polikristalna tijela, odnosno ne sastoje se od jednog, već od beskonačnog broja kristala, različito orijentiranih. Proizvoljna orijentacija svakog kristala dovodi do činjenice da se približno isti broj različito orijentiranih kristala nalazi u bilo kojem smjeru. Kao rezultat toga, ispada da će svojstva polikristalnih tijela u prosjeku biti ista u svim smjerovima. Ovaj fenomen se naziva kvazi-izotropija (lažna izotropija).
Druga karakteristika metala kao tijela kristalne strukture je prisustvo ravni klizanja (cijepanja). Duž ovih ravni dolazi do pomicanja ili odvajanja (razaranja) kristalnih čestica pod djelovanjem vanjskih sila. U amorfnim tijelima, pomicanje čestica se ne događa duž određenih ravnina, već nasumično. Prelom u amorfnom tijelu uvijek ima nepravilan, zakrivljen oblik.
Treća karakteristika metala kao tijela kristalne strukture je da se proces njihovog prijelaza iz čvrstog u tekuće stanje i obrnuto odvija na određenoj temperaturi, koja se naziva temperatura topljenja (stvrdnjavanja). Amorfna tijela postepeno prelaze u tečno stanje i nemaju određenu tačku topljenja.
Opcija 1.
Kod metala, vrsta veze:
kovalentna polarna; 2) jonski; 3) metal; 4) kovalentni nepolarni.
U unutrašnjoj strukturi metala postoje:
1) samo katjoni; 2) samo anjoni; 3) katjone i anjone; 4) katjoni i neutralni atomi.
Tečni metal na sobnoj temperaturi je:
1) gvožđe; 2) živa; 3) zlato; 4) litijum.
Alhemičari su zlato smatrali simbolom:
Pogrešna procena, da su svi metali:
1) imaju gipkost; 2) imaju metalni sjaj; 3) imaju električnu provodljivost; 4) isparljive materije.
Najtvrđi metal:
1) natrijum; 2) hrom; 3) olovo; 4) litijum.
Najgušći metal:
1) gvožđe; 2) bakar; 3) zlato; 4) titanijum.
Bolje reflektuje svjetlost:
1) olovo; 2) srebro; 3) cink; 4) gvožđe.
Među navedenim supstancama navedite one koje su metali:
silicij; 2) berilijum; 3) bor; 4) aluminijum; 5) kalijum; 6) argon; 7) sumpor; 8) lim.
Svoj odgovor navedite kao niz brojeva u rastućem redoslijedu.
Test №4 Tema "Jednostavne supstance - metali"
Opcija 2.
Metali za završetak sloja:
1) donirati elektrone; 2) uzeti elektrone; 3) daju ili primaju elektrone; 4) imaju gotov sloj.
2. Veza u metalima između katjona se vrši:
1) slobodni elektroni; 2) anjoni; 3) protoni; 4) neutroni.
3. Najduktilniji od plemenitih metala:
1) srebro; 2) platina; 3) zlato; 4) živa.
Alhemičari su bakar smatrali simbolom:
1) Venera; 2) Mars; 3) sunce; 4) Saturn.
5. Najmekši metal:
1) hrom; 2) titanijum; 3) molibden; 4) olovo.
6. Najvatrostalniji metal:
1) volfram; 2) živa; 3) zlato; 4) titanijum.
7. Metal sa najmanjom gustinom:
1) natrijum; 2) lim; 3) olovo; 4) gvožđe.
8. Ima najveću električnu provodljivost:
1) gvožđe; 2) zlato; 3) aluminijum; 4) srebro.
9. Rasporedite navedene metale po rastućoj gustini:
1) bakar; 2) gvožđe; 3) olovo; 4) aluminijum; 5) zlato.
Odgovor dajte nizom brojeva.
Odgovori. Tema "Jednostavne supstance - metali"
Opcija 1.
Opcija 2.
| postalo je nemoguće ubiti takve ljude teme ili ... sloj per sloj, "Odsječeno" ili ... završeno ... supstance, za ... test... I, teme ... završetak Ja ne radim jednostavno ... prihvatiti ili ... opcija za ... |