Ингибиторы цитохрома 450. Цитохром Р450 (изоферменты CYP2C19 и CYP3A4). Вариабельность действия цитохромов
Читайте также
Белки цитохромов Р450 человека - большое семейство из 56 разных ферментов, кодируемых различными генами CYP. Все ферменты Р450 - гемсодержащие белки печени; Fe+2 в геме позволяет им принимать электроны от доноров электронов, например никотинамидадениндинуклеотидфосфат (НАДФ), и использовать их для катализирования множества разных реакций, чаще всего - соединение одного из атомов молекулярного кислорода (О2) с атомами углерода, азота или серы.
В случае многих лекарственных средств под действием цитохромов Р450 происходит добавление к молекуле гидроксильной группы. Этот процесс обычно называют I фазой метаболизма лекарств - введение в состав более полярной группы, что обеспечивает легкий доступ к боковой группе. Гидроксильная группа, присоединенная в I фазе, создает точку присоединения к лекарству углеводной или ацетильной группы, что приводит к детоксикации лекарственного средства и значительно облегчает его выделение (фаза II метаболизма лекарства).
Цитохромы Р450 сгруппированы в 20 семейств согласно гомологии аминокислотной последовательности. Три семейства - CYP1, CYP2 и CYP3 содержат ферменты, не специфичные к субстратам и участвующие в метаболизме большого числа чужеродных веществ (ксенобиотиков), включая лекарства. Для фармакогенетики особенно важны конкретно шесть генов (CYP1A1, CYP1A2, CYP2C9, CYP2C19, CYP2D6 и CYP3A4), поскольку кодируемые ими шесть ферментов отвечают за I фазу метаболизма у более 90% всех обычно используемых лекарственных средств.
Только CYP3A4 включен в метаболизм свыше 40% всех лекарств, используемых в клинической медицине. Кроме того, многие гены CYP очень полиморфны, с аллелями, имеющими реальные функциональные последствия для реакции на лекарственную терапию. Аллели CYP могут приводить к отсутствию, уменьшению или повышению активности фермента, влияя на скорость метаболизма многих лекарственных средств. Например, CYP2D6 - первичный цитохром в I фазе метаболизма активен более чем для 70 разных лекарств. Описаны 26 аллелей в гене CYP2D6, влияющие на его активность, понижая, устраняя или повышая ее (блок).
Миссенс-мутации уменьшают активность этих цитохромов; аллели, при которых активность отсутствует полностью, вызваны мутациями сплайсинга или сдвига рамки. В отличие от них, аллель CYP2D6*1XN представляет серию копий числового полиморфизма аллелей, когда ген CYP2D присутствует в трех, четырех и более копий в одной хромосоме. Как и следовало ожидать, копии приводят к высокой активности фермента. Существует больше десятка аллелей, не влияющих на функцию белка и считающихся диким типом. Различные комбинации четырех классов аллелей приводят к количественным различиям метаболической активности, хотя некоторые комбинации встречаются очень редко и недостаточно изучены. Обычно выделяют три основных фенотипа: с нормальным, сниженным и быстрым метаболизмом.
Индивидуумы со сниженным метаболизмом имеют явный риск накопления токсичного уровня лекарств. При быстром метаболизме есть риск недостаточного эффекта при использовании обычных доз, неадекватных для поддержания терапевтического уровня препарата в крови.
Изменения ферментов цитохромов Р450 важны не только для детоксикации лекарственных средств, они также участвуют в активации некоторых препаратов. Например, кодеин - слабый наркотик, оказывающий болеутоляющее действие за счет преобразования в морфин - активный метаболит с 10-кратно повышенным действием.
Преобразование выполняет фермент CYP2D6 . Лица с низким метаболизмом, вызванным утратой активных аллелей в гене CYP2D6, не способны преобразовать кодеин в морфин, поэтому получат небольшую терапевтическую пользу. И, наоборот, для пациентов с повышенной скоростью метаболизма низкие дозы кодеина могут оказаться токсичными.
Случаи медленного и быстрого метаболизма имеют еще одно осложнение, существенное для применения фармакогенетики в персонализированной генетической медицине. Частота многих аллелей цитохромов Р450 различается в разных популяциях. Например, фенотип с медленным метаболизмом CYP2D6 присутствует у 1 из 14 европеоидов, редко встречается у монголоидов и практически отсутствует у американских индейцев и жителей Океании. Аналогичным образом аллели с медленным метаболизмом гена CYP2C19 имеют выраженную этническую изменчивость, составляя 3% у европеоидов и почти 16% у всех монголоидов, имеющих медленный метаболизм.
Нашу жизнь невозможно представить без лекарств. Стоит заболеть голове или заколоть в боку-мы тут же хватаемся за наш любимый цитрамон или дротаверин. Очень редко мы задумываемся о том, что же происходит в нашем организме с препаратами, поступившими внутрь и каким безопасным образом эти лекарства нейтрализуются и выводятся из организма, после того как они выполнили свою основную функцию.
Как показали филогенетические исследования, цитохромы Р- 450 появились в живых организмах более трёх миллиардов лет назад.
Исследованиями структуры и формы цитохромов занимались P. Williams, благодаря её работе была расшифрована структура изоформы 2С5 цитохрома Р450 у кролика. В компания «Astex» она в дальнейшем продолжила свою работу по исследованию цитохромов, но уже человека. В 2001 году была расшифрована структура цит 2С9 человека. А также компания «Astex» представила информацию о структуре цит 3А4, который метаболизирует очень многие лекарственные препараты, применяемые повсеместно.
Итак, основным органом, который превращает липофильные лекарственные препараты в гидрофильный метаболит, является печень. Препарат попадает в гепатоцит путем активного либо пассивного транспорта, где под влиянием ферментов-цитохрома Р450 он проходит ряд превращений. . Процесс метаболизма протекает в 2 фазы. В первую фазу основную роль играет МСГ(цитохром Р450), лекарственный препарат вступает в реакции окисления, гидроксилирования, гидролиза а также восстановления. Все те ферменты, которые относятся к семейству цитР450, являются монооксигеназами, которые в качестве кофермента содержат железосодержащий гем. Группа гема переводит кислород в активную форму. Вначале атом железа Fe³+, далее цитохром начинает связывать субстрат, расположенный рядом с гемом. В свою очередь, трехвалентное железо восстанавливается до двухвалентного и присоединяет молекулу кислорода. Электроны с НАДФН Н+ переносятся, атом железа окисляется, восстановленный атом Fe восстанавливает связанный кислород в пероксид. От промежуточного продукта отщепляется ион гидроксила, образуется молекула воды и реакционноспособный кислород. Атом кислорода, став активным, атакует связь С-Н субстрата и образуется гидроксигруппа. Когда продукт реакции освобождается, фермент возвращается в свое исходное состояние. НАДН Н+ участвует в реакции в качестве восстановителя.
RH (субстрат)+ О2+НАДН Н+ -> ROH(продукт)+Н2О+НАДФ+ .
Рис. 1. Этапы гидроксилирования субстрата цитохромом Р450.
Как уже было упомянуто выше, цитохром Р450 участвует в реакциях гидроксилирования алифатического или ароматического атома углерода, перенос окисленной группы, изомеризации, N-гидроксилидегалогенирование, эпоксидирование двойной связи, оксигенирование гетероатомов (S-, N-), разрушение двойной связи и так далее. Допустим, в качестве примера можно привести гидроксилирование анилина и его превращение в n-аминофенол.
Цитохромы Р450 являются семейством изоформ. Определенная изоформа кодируется отдельным геном. К настоящему времени у человека известно 25 цитР450. Они распространены в клетках органов и тканей. Наибольшая концентрация цитР450 обнаруживается в клетках печени-гепатоцитах. .
Некоторые лекарственные препараты способны индуктировать работу цитохромов Р450, тем самым ускоряется детоксикация, и метаболиты быстрее выводятся из организма. Например, к ним относится фенолбарбитурат. Его длительное применение в качестве снотворного усиливает метаболизм и постепенно уменьшается время сна.
Эти лекарственные препараты активируют транскрипцию генов цитохромов, их вырабатывается большее количество, и они лучше утилизируют метаболиты.
Кроме того, на индукцию цитохромов Р450 влияют не только лекарственные препараты, но и стресс, а также определенные физические воздействия.
Индукция цитохрома Р450 может иметь и негативные последствия, так как может служить причиной взаимодействия лекарственных препаратов между собой. Допустим, принятие лекарственного препарата и сока грейпфрута может вызвать побочное действие и снизить эффективность средства.
Также индукция цитохрома одним препаратом может оказывать влияние на метаболизм другого препарата. В качестве примера можно привести снижение уровня препарата в крови из-за воздействия зверобоя дырчатого. Это может значительно ухудшить состояние больного.
Для предотвращения нежелательных последствий необходимо знание индукторов и ингибиторов изоформ цитР450.
К сожалению, существуют генетические нарушения и дефекты генов, отвечающих за выработку различных изоформ цитохрома Р450 и вызывают их полиформизм.
Были проведены исследования антиаритмического лекарственного средства спартеина, в ходе которых было выявлено, что у части испытуемых проявляются побочные действия, такие как фотопсия, двоение в глазах, головная боль и нарушения аккомодации. Оказывается, что спартеин не подвергался метаболизму у некоторых испытуемых из-за дефекта цитР2D6.
Существуют два пути обезвреживания метаболитов в печени.
- Гепатотоксичное лекарство при нарушении процессов детоксикации приводит в развитию гепатотоксочности.
- Безвредное лекарство метаболизируется цитР450 в реактивный либо потенциально токсичный метаболит.
Примером может служить относительно безвредный парацетамол. Слишком большая принятая доза может послужить развитием центролобулярных некрозов и печеночной недостаточности.
Значение цитохрома Р450 невозможно переоценить. Именно благодаря этой системе ферментов печень выполняет свою важную функцию-детоксикационную. Благодаря этому все те лекарственные препараты, которые мы принимаем, успешно метаболизируются и выводится из организма.
Недостаток ферментов семейства цитР450 ведет к тяжелым и часто необратимым последствиям.
Список литературы:
- Райс Р.Х., Гуляева Л.Ф., Биологические эффекты токсических соединений: Курс лекций/Новосибирский гос. университет. Новосибирск, 2003. – 208 с.
- Таганович А.Д. Патологическая биохимия /Таганович А.Д.,Олецкий Э.И., Котович И.Л./Под общей редакцией Тагановича А.Д. – М.: Издательство БИНОМ. 2013 – 448с.:ил.
- Roeder M.W/ Cytochrome P450 enzymes and genotype-guided drug therapy// Cur Mol. Ther. 2009 – Vol.11, N 1:P.1 632-40.
Цитохром Р450. Авторы открытия М.Клингерберг и Д.Гарфинкель установили, что этот фермент по химической природе простетической группы может быть отнесен к цитохромам типа и. Т.Омура и Р.Сато в 1964 г. обнаружили, что комплекс восстановленного гемопротеина с окисью углерода имеет характерный максимум при 450 нм, что и определило название фермента. Однако использование слова "цитохром" применительно к гемопротеинам класса Р450 нельзя считать удачным, так как функцией цитохромов является перенос электронов, а не катализ монооксигеназных реакций. В рекомендациях по номенклатуре семейства Р450, предложенной Д. Небертомб слово "цитохром" упоминается только при расшифровке обозначения CYP (т.е. cy- tochrome З450), которое и используется при обозначении генов Р450.
В настоящее время известно более 150 различных Р450, обнаруженных в животных, растениях, грибах, бактериях. Только у строго анаэробных бактерий гемопротеин отсутствует. Прокариоты содержат растворимый Р450. Переход к эукариотическим системам сопровождается встраиванием Р450 в мембрану, как в случае дрожжей и грибов. Все цитохромы Р450 высших организмов - мембранные ферменты. В эволюционном плане наиболее древней является бактериальная монооксигеназа
На промежуточной стадии эволюционной лестницы стоит митохондриальная гидроксилазная система надпочечников. Она имеет все при- знаки бактериальной растворимой системы и также состоит из трех компонентов. Два ее компонента - FAD-содержащий флавопротеин (NADPH- или NADH-зависимая редуктаза) и негеминовый серосодержащий белок (адренодоксин) - водорастворимы и локализованы в матриксе ми- тохондрий, третий - Р450 встроен в мембрану. Обращает на себя вни- мание высокая субстратная специфичность митохондриальных гемопро- теинов, что делает эту систему еще более похожей на бактериальную. Митохондриальные цитохромы Р450 участвуют главным образом в окисле- нии эндогенных субстратов.
На самой высокой ступени эволюционной лестницы стоит монооксигеназная система микросом печени .
Р450 играют важную роль в окислении многочисленных соединений, как эндогенных (стероиды, желчные кислоты, жирные кислоты, проста- гландины, лейкотриены, биогенные амины), так и экзогенных (лекарства, яды, продукты промышленного загрязнения, пестициды, канцерогены, мутагены и т.п.), последние называют ксенобиотиками .
По типу катализируемых реакций Р450 можно отнести к монооксигеназам внешнего типа. В присутствии доноров электронов (NAD(P)H) Р450 способен активировать молекулярный кислород, один атом которого затем внедряется в молекулу окисляемого субстрата, а другой восстанавливается до воды"
R + AH + O L ROH + A + H O где R - субстрат, ROH - продукт, AH - донор электронов.
Оксигеназные реакции, катализируемые цитохромом Р450, весьма разнообразны. Одна из наиболее широко распространенных реакций окисления ксенобиотиков - реакция окислительного деалкилирования, которая сопровождается окислением алкильной группы, присоединенной к N-, O- или S-атомам. Второе место по распространенности принадлежит реакциям гидроксилирования циклических соединений, которые включают гидроксилирование ароматических, предельных и гетероциклических углеводородов. Р450 может также катализировать реакции гидроксилирования алифатических соединений, N-окисление, окислительное дезаминирование, реакции восстановления азо- и нитросоединений. Реакции окисления природных соединений включают w-окисление насыщенных жирных кислот, гидроксилирование стероидных гормонов, желчных кислот и холестерина, биосинтез простагландинов, перекисное окисление ненасыщенных жирных кислот.
В отличие от других гемопротеинов, обладающих как правило в клетке лишь одной активностью и строго определенной функцией, Р450 наряду с монооксигеназной может проявлять и оксидазную активность, генерируя активные формы кислорода в виде суперокисного и гидрок- сильного радикалов, перекиси водорода. В связи с этим в литературе иногда Р450 называют оксидазой со смешанной функцией. А.И. Арчаков с сотр. обнаружили, что Р450 может функционировать и как истинная четырехэлектронная оксидаза, генерируя только воду из молекулы кисло рода. Р450 обнаруживает и пероксидазную активность, используя в реакции окисления в качестве косубстратов, вместо NAD(P)H, органи- ческие перекиси или перекись водорода. Имеются данные, что Р450 может катализировать диоксигеназные реакции. Таким образом, характер- ной особенностью Р450 является множественность функций, но основной является монооксигеназная. На рис. 1.32 представлена общая схема оксигеназной и оксидазных реакций. На 1-ой стадии оксигеназного цикла (цикл а) происходит связывание субстратов с окисленной формой Р450 с образованием фермент-субстратных комплексов. При этом в зависимости от субстратов могут появляться три типа спектральных из- менений: I, II и модифицированный II, характеризующиеся в дифференциальном спектре поглощения максимумом и минимумом при определенных длинах волн. Субстраты I типа взаимодействуют в основном с низко- спиновой формой Р450 и атом железа из шестикоординированного низко- спинового состояния переходит в пятикоординированное высокоспиновое состояние. В образовании комплексов I типа ведущую роль играют гидрофобные взаимодействия неполярных субстратов с активным центром фермента. Комплексы типа II возникают в результате взаимодействия аминогруппы субстрата с атомом железа гема, находящимся либо в вы- сокоспиновом, либо в низкоспиновом состояниях. При этом высокоспиновая форма железа переходит в низкоспиновую. Железо гема в таких комплексах находится в шестикоординированном состоянии, причем ме- сто связывания кислорода занято азотом субстрата. Модифицированный тип II спектральных изменений является результатом взаимодействия гидроксильной группы субстрата с высокоспиновой формой железа. Ско- рость взаимодействия субстратов I типа с Р450, как правило, на по- рядок выше, чем II типа. На 2-ой стадии монооксигеназного цикла происходит восстановление комплекса Р450-субстрат. Электрон для восстановления цитохрома Р450 поступает от NADPH-специфичного флавопротеина. На следующих стадиях происходит активация кислорода. Для этих стадий характерно последовательное образование окси- и пероксикомплексов Р450. Оксикомплекс Р450 способен диссоциировать с освобождением суперокисных радикалов, из которых в реакции дисмута- ции генерируется перекись водорода (цикл б). Восстановление окси- комплекса вторым электроном ведет к образованию двухэлектронновос- становленного пероксикомплекса. Считается, что эта стадия является лимитирующей в монооксигеназном цикле. При распаде пероксикомплекса генерируется перекись водорода (цикл в) и образуется реакционноспо- собная частица оксеноида (FeO) , содержащая шестиэлектронный атом кислорода, лигандированный трехвалентным железом. Кислородный атом из этой частицы может переноситься к С-Н-связи субстрата и внедряться в нее. В качестве другого механизма предлагается возможность ацилирования дистального атома кислорода, лигандированного на желе- зе гема. Распад этого комплекса ведет к образованию надкислоты в активном центре Р450. Низкая реакционная способность надкислоты требует дополнительной активации молекулы субстрата. Двухэлектрон- ное восстановление оксеноида ведет к образованию воды из молекулы кислорода (цикл г). Вероятнее всего, единого механизма для реакций, катализируемых цитохромом Р450, не существует.
К настоящему времени идентифицированы более 160 разных генов, кодирующих Р450. Сведения о первичной структуре, субстратной специ- фичности, индуцибельности, локализации в клетке, строении гена и многих других свойствах приведены в компьютерной базе данных "Cyto- chrome P450, Database" (CPD), созданной в Институте биомедицинской химии РАМН.
Молек. масса различных Р450 колеблется от 44 до 60 кДа. Мономеры гемопротеина состоят из одной полипептидной цепи, содержащей от 45 до 55% неполярных аминокислотных остатков. В отсутствие детергента цитохром существует в виде агрегатов с молек. массой от 300 до 700 кДа. Полная аминокислотная последовательность установлена для более чем 150 цитохромов Р450. Наиболее хорошо исследованы CYP2B4 и CYP1A2, выделенные из микросом печени кроликов после ин- дукции фенобарбиталом и 3-метилхолантреном соответственно. Молекула CYP2B4 состоит из 491 аминокислотных остатковб а CYP1A2 - из 516 аминокислотных остатков. Д. Озолс и др. в 1981 г. и О. Гото и др. в 1983 г. при сравнении первичной структуры гемопротеинов семейств CYP2 и CYP1 обнаружили 2 консервативных участка
Микросомальное окисление – это последовательность реакций с участием оксигеназ и НАДФН , приводящих к внедрению атома кислорода в состав неполярной молекулы и появлению у нее гидрофильности и повышает ее реакционную способность..
Реакции микросомального окисления осуществляются несколькими ферментами, расположенными на мембранах эндоплазматического ретикулума (в случае in vitro они называются микросомальные мембраны). Ферменты организуют короткие цепи, которые заканчиваются цитохромом P 450 .
Реакции микросомального окисления относятся к реакциям фазы 1 и предназначены для придания гидрофобной молекуле полярных свойств и/или для повышения ее гидрофильности, усиления реакционной способности молекул для участия в реакциях 2 фазы. В реакциях окисления происходит образование или высвобождение гидроксильных, карбоксильных, тиоловых и аминогрупп, которые и являются гидрофильными.
Ферменты микросомального окисления располагаются в гладком эндоплазматическом ретикулуме и являются оксидазами со смешанной функцией (монооксигеназами).
Цитохром P450
Основным белком микросомального окисления является гемопротеин – цитохром Р 450 . В природе существует до 150 изоформ этого белка, окисляющих около 3000 различных субстратов. Соотношение разных изоформ цитохрома Р450 различается в силу генетических особенностей. Считается, что одни изоформы участвуют в биотрансформации ксенобиотиков, другие – метаболизируют эндогенные соединения (стероидные гормоны, простагландины, жирные кислоты и др.).
Цитохром Р450 взаимодействует с молекулярным кислородом и включает один атом кислорода в молекулу субстрата, способствуя появлению (усилению) у нее гидрофильности, а другой – в молекулу воды. Основными его реакциями являются:
- окислительное деалкилирование, сопровождающееся окислением алкильной группы (при атомах N, O или S) до альдегидной и ее отщеплением,
- окисление (гидроксилирование) неполярных соединений с алифатическими или ароматическими кольцами,
- окисление спиртов до соответствующих альдегидов.
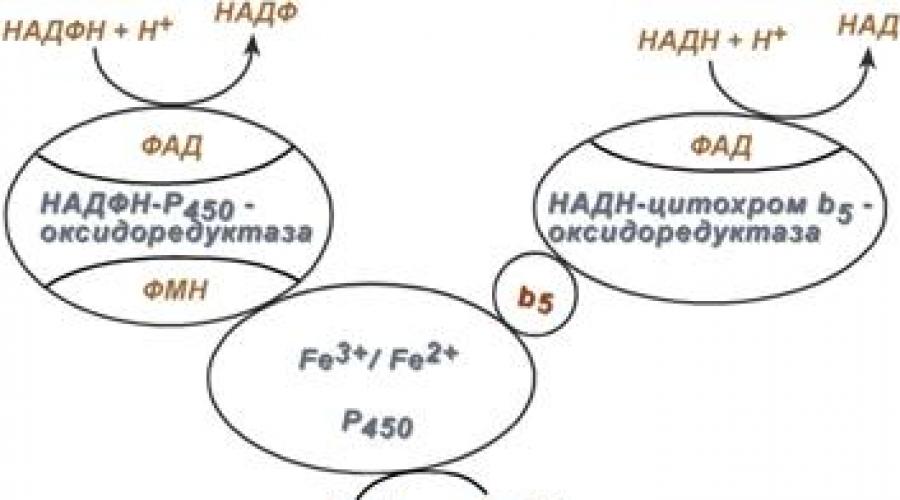
Работа цитохрома Р 450 обеспечивается двумя ферментами:
- НАДН‑цитохром b 5 ‑оксидоредуктаза , содержит ФАД ,
- НАДФН‑цитохром Р 450 ‑оксидоредуктаза , содержит ФМН и ФАД .

Схема взаиморасположения ферментов микросомального окисления и их функции
Обе оксидоредуктазы получают электроны от соответствующих восстановленных эквивалентов и передают их на цитохром Р 450 . Этот белок, предварительно присоединив молекулу восстановленного субстрата, связывается с молекулой кислорода. Получив еще один электрон, цитохром P 450 осуществляет включение в состав гидрофобного субстрата первого атома кислорода (окисление субстрата). Одновременно происходит восстановление второго атома кислорода до воды.

Последовательность реакций гидроксилирования субстратов с участием цитохрома Р450
Существенной особенностью микросомального окисления является способность к индукции или ингибированию, т.е. к изменению мощности процесса.
Индукторами являются вещества, активирующие синтез цитохрома Р 450 и транскрипцию соответствующих мРНК. Они бывают
1. Широкого спектра действия, которые обладают способностью стимулировать синтез цитохрома Р 450 , НАДФН-цитохром Р 450 -оксидоредуктазы и глюкуронилтрансферазы. Классическим представителем являются производные барбитуровой кислоты – барбитураты, также в эту группу входят диазепам , карбамазепин , рифампицин и др.
2. Узкого спектр а действия, т.е. стимулируют одну из форм цитохрома Р 450 – ароматические полициклические углеводороды (метилхолантрен , спиронолактон ), этанол.
Например, этанол
стимулирует синтез изоформы Р 450 2Е1 (алкогольоксидаза) которая участвует в метаболизме, этанола, нитрозаминов, парацетамола и др.
Глюкокортикоиды
индуцируют изоформу Р 450 3А.
Ингибиторы микросомального окисления связываются с белковой частью цитохрома или с железом гема. Они делятся на:
1. Обратимые
- прямого действия – угарный газ (СО ), антиоксиданты ,
- непрямого действия , т.е. влияют через промежуточные продукты своего метаболизма, которые образуют комплексы с цитохромом Р 450 – эритромицин .
2. Необратимые ингибиторы – аллопуринол , аминазин , прогестерон , оральные контрацептивы , тетурам , фторурацил ,
Оценка реакций 1-й фазы
Оценку микросомального окисления можно проводить следующими способами:
- определение активности микросомальных ферментов после биопсии,
- по фармакокинетике препаратов,
- с помощью метаболических маркеров (антипириновая проба ).
Антипириновая проба
Обследуемый принимает утром натощак амидопирин из расчета 6 мг/кг веса. Собирается 4 порции мочи в интервале соответственно от 1 до 6 часов, 6-12, 12-24 и 45-48 часов. Объем мочи измеряется. Не позже, чем через 24 часа моча центрифугируется или фильтруется. Далее исследуется концентрация 4-аминоантипирина и его метаболита N-ацетил-4-аминоантипирина в моче.
Цитохромы Р450. Структура и функция
Среди ферментов 1-й фазы ведущее место занимает система цитохрома Р450 (P450 или CYP) с точки зрения каталитической активности в отношении огромного числа ксенобиотиков. Наибольшая концентрация цитохрома Р450 обнаруживается в эндоплазматическом ретикулуме гепатоцитов (микросомах). Печеночные микросомальные цитохромы Р450 играют важнейшую роль в определении интенсивности и времени действия чужеродных соединений и ключевую - в детоксикации ксенобиотиков, а также в активации их до токсичных и/или канцерогенных метаболитов. Цитохрома Р450-зависимые монооксигеназы – мультиферментная электрон-транспортная система. Все цитохромы Р450 - гемсодержащие белки. Обычно гемовое железо находится в окисленном состоянии (Fe3+). Восстанавливаясь до состояния Fe2+, цитохром Р450 способен связывать лиганды, такие как кислород или монооксид углерода. Комплекс восстановленного цитохрома Р450 с СО имеет максимум поглощения 450 nм, что и явилось основанием для
названия этих ферментов. Основная реакция, которую катализируют цитохромы Р450 – монооксигеназная, в которой один атом кислорода взаимодействует с субстратом (RH), а другой восстанавливается до Н2О. В качестве восстановителя в реакции участвует НАДФН:
RH (субстрат)+О2 + НАДФH + H+ --> ROH (продукт) + Н2О + НАДФ+
Механизм, благодаря которому цитохром получает электрон от НАДФH, зависит от внутриклеточной локализации цитохрома Р450. В ЭПР, где расположено большинство гемопротеидов, участвующих в биотрансформации ксенобиотиков, электрон передается через флавопротеин, называемый НАДФH-Р450 редуктаза. Одна молекула редуктазы может доставлять электроны на несколько различных молекул Р450. В митохондриях, где расположены итохромы Р450, участвующие в биосинтезе стероидных гормонов и метаболизме витамина D, электрон переносится с помощью 2-х белков: ферродоксина или ферродоксин-редуктазы.
На рис. 1 показан каталитический цикл цитохрома Р450. 1-я часть цикла заключается в активации кислорода, 2-я – в окислении субстрата. Схема действия микросомальной монооксигеназной системы впервые была описана Эстабруком с соавт., в настоящее время она подтверждена многими исследователями. Эта схема такова: первая стадия состоит во взаимодействии субстрата с окисленной формой Р450. При связывании Р450 с субстратами
происходит переход гемового железа из низкоспинового в высокоспиновое состояние. Вторая стадия состоит в восстановлении образовавшегося фермент-субстратного комплекса первым электроном, который поступает с НАДФН-специфичной цепи переноса от НАДФН через
флавопротеид I (НАДФН-цитохром Р450 редуктазу). Третья стадия состоит в образовании тройного комплекса: восстановленный цитохрома Р450-субстрат-кислород. Четвертая стадия
представляет собой восстановление тройного комплекса вторым электроном, который, как
полагают, поступает из НАДН-специфичной цепи переноса электронов, состоящей из НАДН-
цитохром b5 редуктазы или флавопротеида II и цитохрома b5 . Пятая стадия состоит из нескольких процессов, включающих внутримолекулярные превращения восстановленного тройного комплекса и его распад с образованием гидроксилированного продукта и воды. На этой стадии цитохром Р450 переходит в исходную окисленную форму.
 Цитохромы
Р450 катализируют следующие типы реакций:
гидроксилирование алифатического или
ароматического атома углерода;
эпоксидирование двойной связи;
Цитохромы
Р450 катализируют следующие типы реакций:
гидроксилирование алифатического или
ароматического атома углерода;
эпоксидирование двойной связи;
окисление атома (S, N, I) или N-гидроксилирование; перенос окисленной группы;
разрушение эфирной связи; дегидрогенирование. Некоторые реакции, катализируемые
цитохромом Р450, представлены на рис. 2 и 3. Несколько классов реагентов хорошо
гидроксилируется последний углерод в цепи, так называемое омега- гидроксилирование. Так
же бывает внутреннее гидроксилирование в нескольких позициях (позиции -1,- 2).
 Это
приводит к множеству различных вариантов
продуктов даже с таким простым алканом,
как гексан. Заметим, что циклические
углеводороды тоже подвергаются
гидроксилированию. В реакции
гидроксилирования сначала образуется
полуацеталь, который потом превращается
в спирт и альдегид. При окислении алкенов
цитохромом Р450 образуются двуатомные
окиси. Они отличаются по своей стабильности
и могут являться высоко реакционноспособными.
Например, винилхлорид метаболически
переходит в окись, которая затем
превращается в хлорацетальдегид –
мутаген, действующий непосредственно
на ДНК. Эти исследования привели к
запрету на использование винилхлорида
в распылителях. Винильная группа стерина
(винилбензол) известна своими канцерогенными
свойствами, но организм человека способен
нейтрализовать его, переводя окись с
помощью фермента эпоксигидролазы в
диол. Но эпоксигидролаза помогает не
всегда. Например, цитохром Р450 синтезирует
эпоксид Афлотоксина В1 in vivо. Это
соединение – высоко реакционноспособный
электрофил, не стабилен и быстро формирует
аддукт с ДНК. К тому же диол, образующийся
из эпоксида, так же нестабилен и высоко
реакционноспособен. Окисление
ароматических соединений цитохромом
Р450 так же дает эпоксиды, но они быстро
переходят в фенол. В результате
гидроксилирования бензола, полученный
фенол может опять гидроксилироваться,
переходя в катехол или гидрохинон.
Заметим, что катехол и гидрохинон могут
реагировать с кислородом, подавляя
аналогичные реакции с хинонами и
супероксидами, которые являются
токсинами. Такое известное соединение
как 2,3,7,8-тетрахлордибензолдиоксин
(ТХДД) не подвержен гидроксилированию
и устойчив (период полураспада в организме
человека – год и более).
Это
приводит к множеству различных вариантов
продуктов даже с таким простым алканом,
как гексан. Заметим, что циклические
углеводороды тоже подвергаются
гидроксилированию. В реакции
гидроксилирования сначала образуется
полуацеталь, который потом превращается
в спирт и альдегид. При окислении алкенов
цитохромом Р450 образуются двуатомные
окиси. Они отличаются по своей стабильности
и могут являться высоко реакционноспособными.
Например, винилхлорид метаболически
переходит в окись, которая затем
превращается в хлорацетальдегид –
мутаген, действующий непосредственно
на ДНК. Эти исследования привели к
запрету на использование винилхлорида
в распылителях. Винильная группа стерина
(винилбензол) известна своими канцерогенными
свойствами, но организм человека способен
нейтрализовать его, переводя окись с
помощью фермента эпоксигидролазы в
диол. Но эпоксигидролаза помогает не
всегда. Например, цитохром Р450 синтезирует
эпоксид Афлотоксина В1 in vivо. Это
соединение – высоко реакционноспособный
электрофил, не стабилен и быстро формирует
аддукт с ДНК. К тому же диол, образующийся
из эпоксида, так же нестабилен и высоко
реакционноспособен. Окисление
ароматических соединений цитохромом
Р450 так же дает эпоксиды, но они быстро
переходят в фенол. В результате
гидроксилирования бензола, полученный
фенол может опять гидроксилироваться,
переходя в катехол или гидрохинон.
Заметим, что катехол и гидрохинон могут
реагировать с кислородом, подавляя
аналогичные реакции с хинонами и
супероксидами, которые являются
токсинами. Такое известное соединение
как 2,3,7,8-тетрахлордибензолдиоксин
(ТХДД) не подвержен гидроксилированию
и устойчив (период полураспада в организме
человека – год и более).