Klor hemijskih svojstava. Metode hlora dobivanja hlora. Neproporcionalni hlor u vodi i vodenoj alkalis rješenjima
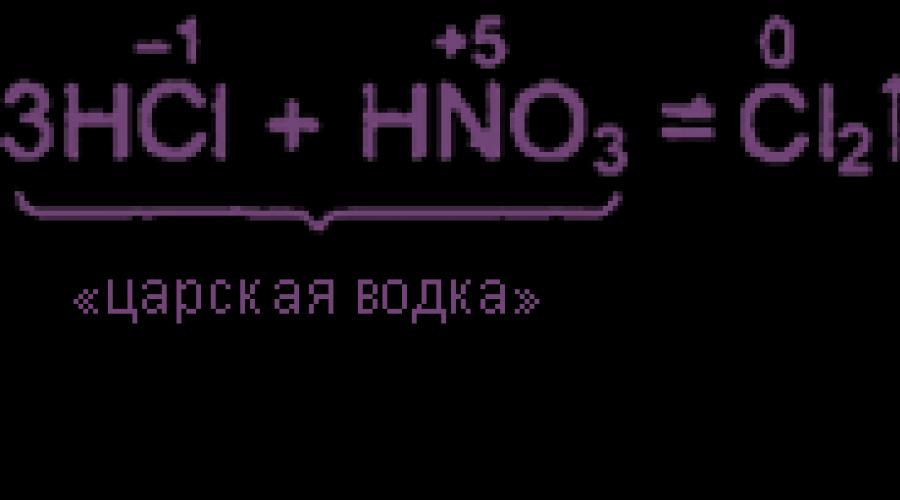
Definicija
Hlor - Hemijski element VII grupa 3 Periodični sistem hemijskih elemenata D.i. Mendeleeva. Nemetal.
Odnosi se na elemente - P-porodica. Halogen. Serijski broj - 17. Struktura vanjskog elektronskog nivoa je 3S 2 3 P 5. Relativna atomska masa - 35,5 AEM. Molekula klora Double - CL 2.
Hemijska svojstva hlor
Klor reagira sa jednostavnim metalima:
CL 2 + 2SB \u003d 2SBCL 3 (T);
CL 2 + 2FE \u003d 2FECL 3;
CL 2 + 2na \u003d 2Nacl.
Hlor interaktiva jednostavnim ne-metalnim tvarima. Stoga se prilikom interakcije sa fosforom i sumporom formiraju odgovarajući hloridi, sa fluoridom - fluoridima, hidrogen - hloridnim vodonik, sa kisikom - oksidima itd.:
5cl 2 + 2p \u003d 2HCL 5;
CL 2 + 2S \u003d SCL 2;
CL 2 + H 2 \u003d 2HCL;
CL 2 + F 2 \u003d 2CLF.
Klor je u stanju da preseca bromin i jod iz njihovih spojeva sa vodikom i metalima:
CL 2 + 2Hbr \u003d br 2 + 2hcl;
CL 2 + 2Ai \u003d I 2 + 2Nacl.
Klor se može otopiti u vodi i alkalisu, dok se pojavljuje reakcija nerazpraviranja hlora, a sastav reakcijskih proizvoda ovisi o njenim uvjetima:
CL 2 + H 2 o ↔ HCl + HCLO;
CL 2 + 2NAOH \u003d NACL + NACLO + H 2 O;
3 CL 2 + 6NAOH \u003d 5Nacl + Naclo 3 + 3h 2 O.
Klor interakcije s neformiranje oksidom - sa formiranjem tvari s trivijalnim imenom - fosgene, a amonijak formira amonijum trihlorid:
CL 2 + CO \u003d CoCL 2;
3 CL 2 + 4NH 3 \u003d NCL 3 + 3NH 4 CL.
U reakcijama, hlor prikazuje svojstva oksidansa:
CL 2 + H 2 S \u003d 2HCL + S.
Klor ulazi u reakciju interakcije s organskim tvarima klase alkana, alkena i arene:
CH 3 -CH 3 + CL 2 \u003d CH 3 -CH 2 -Cl + HCL (stanje - UV zračenje);
CH 2 \u003d CH 2 + CL 2 \u003d CH 2 (CL) -CH 2 -Cl;
C 6 H 6 + CL 2 \u003d C 6 H 5 -Cl + HCL (KAT \u003d FECL 3, Alcl 3);
C 6 H 6 + 6CL 2 \u003d C 6 H 6 CL 6 + 6HCL (stanje - UV zračenje).
Fizička svojstva hlor
Hlor - žuto-zeleni gas. Termički stabilan. Kad je hlorid zasićen hlorom, formiran je čvrsti kriot. Dobro je topivo u vodi, rastvaranje ("Voda hlora") u velikoj je mjeri izložena u velikoj mjeri. Carbon tetraklorid je rastvoren, tečni Sicl 4 i Ticl 4. Slabo rastvoreno u zasićenoj otopini natrijum-hlorida. Ne reagira sa kisikom. Jak oksidant. Tačka ključanja - -34.1C, topljenje - -101,03C.
Dobijanje hlora
Prije toga, hlor je dobiven metodom Shelele (reakcija interakcije manganskog oksida (VI) sa hidrokloronom kiselinom) ili dicon metodom (reakcija interakcije kloroodrova sa kisikom):
MNO 2 + 4HCL \u003d MNCL 2 + CL 2 + 2H 2 o;
4hcl + o 2 \u003d 2h 2 O + 2 CL 2.
Danas se za dobivanje hlora koriste sljedeće reakcije:
NAOCL + 2HCL \u003d NACL + CL 2 + H 2 O;
2kmno 4 + 16hcl \u003d 2kcl + 2mncl 2 +5 CL 2 + 8h 2 o;
2Nacl + 2h 2 O \u003d 2Aoh + CL 2 + H 2 (stanje - elektroliza).
Upotreba hlora
Klor se široko koristi u raznim oblastima industrije, tako da se koristi u proizvodnji polimernih materijala (polivinil hlorida), izbjeljivanje, hloroorganski insekticidi (heksahloran), borbene tvari (fosgen), u prehrambenoj industriji, u prehrambenoj industriji, u prehrambenoj industriji, u prehrambenoj industriji, u metalurgiji itd.
Primjeri rješavanja problema
Primjer 1.
Primer 2.
| Zadatak | Kakvu količinu, masa i količina hlor supstance su istaknuta (n.u.) sa interakcijom od 17,4 g mangan oksida (iv) sa hidrokloronom kiselinom uzetom viškom? |
| Odluka | Pišemo jednadžbu reakcije interakcije manganskog oksida (iv) sa hidrokloronom kiselinom: 4hcl + mno 2 \u003d mncl 2 + cl 2 + 2h 2 o. Molarne mase manganskih oksida (iv) i hlora, izračunato pomoću tablice hemijskih elemenata D.i. Mendeleeva - 87 i 71 g / mol, respektivno. Izračunajte količinu mangand oksida (iv): n (mno 2) \u003d m (mno 2) / m (mno 2); n (mno 2) \u003d 17,4 / 87 \u003d 0,2 mol. Prema reakcijskoj jednadžbi n (MNO 2): N (CL 2) \u003d 1: 1, dakle, n (CL 2) \u003d N (MNO 2) \u003d 0,2 mol. Tada će masa i količina hlora biti jednaki: m (CL 2) \u003d 0,2 × 71 \u003d 14,2 g; V (CL 2) \u003d N (CL 2) × V M \u003d 0,2 × 22,4 \u003d 4,48 l. |
| Odgovoriti | Količina tvari klora je 0,2 mol, težina - 14,2 g, zapremina - 4,48 litara. |
CL 2 za otprilike. T - žuto-zeleni plin sa oštrim mirisom za sjeckanje, teži od zraka - 2,5 puta, u vodi u vodi (~ 6,5 g / l); x. R. U ne-polarnim organskim otapalima. Poplava se nalazi samo u vulkanskim gasovima.
Metode za dobivanje
Na osnovu procesa oksidacije aniona CL -
2cl - - 2E - \u003d CL 2 0
Industrijski
Elektroliza vodenih rješenja hlorida, češće - NACL:
2Nacl + 2N 2 O \u003d CL 2 + 2NAOH + H 2
Laboratorija
Oksidacija koncepta. HCI razni oksidanti:
4HCI + MNO 2 \u003d CL 2 + MPCL 2 + 2N 2 o
16nSL + 2kMPO 4 \u003d 5cl 2 + 2MNCL 2 + 2KCL + 8N 2 O
6hcl + kslo 3 \u003d SCL 2 + KCL + 3N 2 O
14HCL + K 2 CR 2 O 7 \u003d 3CL 2 + 2CCL 3 + 2KCL + 7N 2 O
Hemijska svojstva
Hlor je vrlo jak oksidantizam. Oksidizira metale, nemetale i složene tvari, koje se pretvaraju u vrlo stabilne CL anioni -:
CL 2 0 + 2E - \u003d 2cl -
Reakcije sa metalima
Aktivni metali u atmosferi suhih plinovitih hlora zapaljeni su i spaljeni; Istovremeno se formiraju hloridi metala.
CL 2 + 2na \u003d 2Nacl
3cl 2 + 2FE \u003d 2FECL 3
Neefktiviji metali su lakši za oksidiranje mokrim hlorom ili njegovim vodenim rješenjima:
CL 2 + CU \u003d CUCL 2
3cl 2 + 2au \u003d 2aucl 3
Reakcije sa nemetalima
Klor ne direktno komunicira s O 2, N 2, C. s ostalim nemetalima reakcije javljaju se u različitim uvjetima.
Formirani su Nemmetalov halogenide. Najvažnija je reakcija interakcije s vodikom.
CL 2 + H 2 \u003d 2NC1
CL 2 + 2S (MELT) \u003d S 2 CL 2
ZCL 2 + 2R \u003d 2PCL 3 (ili PCL 5 - u višku CL 2)
2cl 2 + si \u003d sicl 4
3cl 2 + i 2 \u003d 2icl 3
Preseljenje besplatnih nemetala (BR 2, I 2, N 2, S) iz njihovih spojeva
CL 2 + 2kbr \u003d br 2 + 2kcl
CL 2 + 2ki \u003d i 2 + 2kcl
CL 2 + 2Hi \u003d i 2 + 2hcl
CL 2 + H 2 S \u003d S + 2HCL
ZSL 2 + 2NH 3 \u003d N 2 + 6HCL
Neproporcionalni hlor u vodi i vodenoj alkalis rješenjima
Kao rezultat samozavodljivog izlječenja, neki atomi hlora pretvaraju se u CL -, a drugi u pozitivnom stupnju oksidacije uključeni su u CLO ili CLO 3 anioni.
CL 2 + H 2 O \u003d HCL + NCLO HLORNOTY K-TA
CL 2 + 2CON \u003d KCL + KCLO + H 2 O
3cl 2 + 6Con \u003d 5kcl + kclo 3 + 3n 2 o
3cl 2 + 2s (IT) 2 \u003d CACL 2 + CA (CLO) 2 + 2N 2 o
Te su reakcije važne jer se dobivaju srednje sredstvo za kisike klora:
Kclo 3 i CA (CLO) 2 - hipohlori; Kclo 3 - kalijum hlorat (burtupolet sol).
Interakcija hlora sa organskim tvarima
a) zamjena atoma vodika u molekulama
b) dodavanje molekula CL 2 na mjestu lomljenja višestrukih krakova ugljika
H 2 C \u003d CH 2 + CL 2 → CLH 2 C-CH 2 CL 1,2-dikloroetan
HC≡CH + 2CL 2 → CL 2 HC-CHCL 2 1,1,2,2-tetrahloutoetan
Hlorid i klorovodonična kiselina
Gasovitni hlorid
Fizička i hemijska svojstva
HCl - Hloronik hlorida. Za otprilike T - beszv. Plin s oštrim mirisom, prilično lako ukapljen (t. Pl. -114 ° C, tako teško. -85 ° C). -85 ° C). Anhidrozan HCl i plinovito, a u tekućim stanjima ne-elektro-provodljivih, hemijski inertne u odnosu na metale, okside i hidrokside metala, kao i mnogim drugim tvarima. To znači da u nedostatku vode, hlorid ne pokazuje kiseline svojstva. Samo s vrlo visokim t gasovim HCL-om reagira s metalima, pa čak i kao niskoktivni kao i Cu i AG.
Svojstva restauracije utikača u HCL-u također se manifestuju u blagom stepenu: Oksidirana je fluor oko. T, kao i na visokom T (600 ° C) u prisustvu katalizatora reagira reagira s kisikom:
2hcl + F 2 \u003d CL 2 + 2HF
4hcl + o 2 \u003d 2SL 2 + 2N 2 o
HCL gas se široko koristi u organskoj sintezi (hidroholonirati reakciju).
Metode za dobivanje
1. Sinteza jednostavnih supstanci:
H 2 + CL 2 \u003d 2HCL
2. Formira se kao nusproizvod kada HC HC:
R-H + CL 2 \u003d R-CL + HCL
3. U laboratoriji se dobiva betonom. H 2 Dakle 4 za hloride:
H 2 SO 4 (CONC.) + NACL \u003d 2HCL + NAHSO 4 (sa slabim grijanjem)
H 2 SO 4 (CONC.) + 2Nacl \u003d 2hcl + na 2 SO 4 (s vrlo jakim grijanjem)
HCL vodena otopina - teška kiselina (hlorid ili hidrouklorik)
HCl je vrlo dobro rastvorljiv u vodi: za otprilike. T 1 L H 2 o rastvara se ~ 450 litara plina (raspuštanje je popraćeno oslobađanjem značajne količine topline). Zasićeno rješenje ima masovnu djelić HCl, jednaka 36-37%. Ovo rješenje ima vrlo oštar, ugušeni miris.
HCL molekuli u vodi gotovo se u potpunosti raspadaju ioni, tj., Vodena otopina HCL-a je jaka kiselina.
Hemijska svojstva klorovodične kiseline
1. Voda otopljena u vodi HCL izlaže sva uobičajena svojstva kiselina zbog prisustva H + jona
HCl → H + + CL -
Interakcija:
a) sa metalima (BC):
2HCL 2 + ZN \u003d ZNCL 2 + H 2
b) sa osnovnim i amfoternim oksidima:
2hcl + Cuo \u003d Cucl 2 + H 2 o
6hcl + al 2 o 3 \u003d 2alcl 3 + zn 2 o
c) sa bazama i amfoteričnim hidroksidima:
2hcl + SA (IT) 2 \u003d CACL 2 + 2N 2 O
3hcl + al (IT) 3 \u003d alsl 3 + zn 2 o
d) sa solima slabijih kiselina:
2HCL + SACO 3 \u003d CACL 2 + CO 2 + H 3 O
HCl + C 6 H 5 ONA \u003d C 6N 5 na + NACL
e) sa amonijakom:
HCl + NH 3 \u003d NH 4 CL
Reakcije sa jakim oksidantima F 2, MNO 2, KMNO 4, KCLO 3, k 2 CR 2 O 7. Anion CL - oksidiran za besplatan halogen:
2cl - - 2E - \u003d CL 2 0
Jednadžbe reakcije vide "dobivanje hlora". Od posebnog značaja je OSR između hlorovoloričnih i dušičnih kiselina:

Reakcije sa organskim spojevima
Interakcija:
a) sa amininama (kao organskim terenima)
R-NH 2 + HCL → + CL -
b) sa aminokiselinama (kao amfotegora veza)

Oksidi i oksokuslovni hlor
Kiseli oksidi

Kiselina

Sololi.
Hemijska svojstva
1. Svi klorski oksokoslovi i njihove soli su jaki oksidanti.
2. Gotovo svi spojevi tokom grijanja razgrađuju se zbog intramolekularnog oksidacijskog oporavka ili neproporcionalne.

Puder za izbjeljivanje
Klor (bellen) vapno - mješavina hipoklorita i kalcijum hlorida, ima izbjeljivanje i dezinfekciju efekta. Ponekad se smatra primerom mešovite soli, koji u svom sastavu istovremeno anion dvije kiseline:

Zhawl Water.
Vodena otopina klorida i gapoklorita kalijum kcl + kclo + h 2 o
Karakteristike elemenata VII grupe glavne podskupine, na primjeru hlora
Opće karakteristike podskupine
Tabela 1. Nomenklatura elemenata podgrupe VIII
P-elementi, tipični, nemetali (Astat - polumetar), halogeni.
Elektronski element Chart Hal (Hal ≠ F):
Za elemente podgrupe VIII karakteriziraju sljedeća valencija:
Tabela 2. Valencija
3. Za elemente podgrupe VIII, posebni su sljedeći stupnjevi oksidacije:
Tabela 3. Stupnjevi oksidacije elementa
Karakteristično za hemijski element
Hlor - Element VII Grupa. Serijski broj 17.
Relativna atomska težina: 35,4527 a. e. m. (g / mol)
 Broj protona, neutrona, elektrona: 17,18,17
Broj protona, neutrona, elektrona: 17,18,17
ATOM struktura:
![]()
Elektronska formula:
Tipični stepeni oksidacije: -1, 0, +1, +3, +4, +5, +7
Energija jonizacije: 1254,9 (13,01) KJ / MOL (EV)
Elektronska afiniteta: 349 (KJ / MOL)
Električna energija Paulonga: 3.20
Karakteristično za jednostavnu supstancu
Tip komunikacije: savez koji nije-polar
Dvostruka molekula
Izotopi: 35 CL (75,78%) i 37 CL (24,22%)
Vrsta kristalne rešetke: molekularno
Termodinamički parametri
Tabela 4.
Fizička svojstva
Tabela 5.
Hemijska svojstva
Vodena otopina hlora u velikoj mjeri se raspada ("voda hlora")
1 faza: CL 2 + H 2 O \u003d HCL + HOCL
2 faza: hocl \u003d hcl + [o] - atomski kisik
Oksidativni kapacitet u podskupini se smanjuje od fluorida do joda \u003d ˃
Hlor jaki oksidantor:
1. Interakcija sa jednostavnim supstancama
a) sa vodikom:
CL 2 + H 2 \u003d 2HCL
b) sa metalima:
CL 2 + 2na \u003d 2Nacl
3cl 2 + 2FE \u003d 2FECL 3
c) sa nekim manje električnim negativnim nemetalima:
3cl 2 + 2p \u003d 2PCL 3
CL 2 + S \u003d SCL 2
Sa kiseonikom, ugljičnim i dušikovim hlorom direktno ne reaguje!
2. Interakcija sa složenim tvarima
a) sa vodom: vidi gore
b) sa kiselinama: ne reaguje!
c) sa alkalis rješenjima:
na hladnoći: CL 2 +2 naoh \u003d nacl + naclo + h 2 o
kada se zagrijava: 3cl 2 + 6 koh \u003d 5kcl + kclo 3 + 3h 2 o
e) sa mnogim organskim tvarima:
CL 2 + CH 4 \u003d CH 3 CL + HCL
C 6 H 6 + CL 2 \u003d C 6 H 5 CL + HCL
Najvažniji slojevi hlor
 Hloridni vodonik hlorid(HCl) - bezbojni, termički stabilan plin (u normalnim uvjetima) sa oštrim mirisom, pušenje u vlažnom zraku, lako se otopi u vodi (do 500 količina plina po količini vode) sa formiranjem hloroklorične) kiseline. AT -114.22 ° C HCL prelazi u tešku stanja. U čvrstom stanju, hlorid je u obliku dvije kristalne modifikacije: rombični, stabilni ispod i kubični.
Hloridni vodonik hlorid(HCl) - bezbojni, termički stabilan plin (u normalnim uvjetima) sa oštrim mirisom, pušenje u vlažnom zraku, lako se otopi u vodi (do 500 količina plina po količini vode) sa formiranjem hloroklorične) kiseline. AT -114.22 ° C HCL prelazi u tešku stanja. U čvrstom stanju, hlorid je u obliku dvije kristalne modifikacije: rombični, stabilni ispod i kubični.
Vodena otopina hlorida vodika naziva se hidroukloronska kiselina. Kada se otopi u vodi, slijedeći procesi nastavljaju:
HCL R + H 2 O W \u003d H 3 O + F + CL -
Proces raspuštanja je vrlo egzotermičan. Sa HCL-om za vodu formira azeotropnu smjesu. To je jaka monosokond kiselina. Energetski komunicira sa svim metalima koji stoje u nizu napona s lijeve strane vodonika, sa osnovnim i amfoterskim oksidima, bazama i solima, formirajući sol - chlorida:
MG + 2 HCL → MGCL 2 + H 2
Feo + 2 HCl → FECL 2 + H 2 O
Pod djelovanjem jakih oksidacijskih sredstava ili sa elektrolizom, klorid pokazuje reduciranje svojstava:
MNO 2 + 4 HCL → MNCL 2 + CL 2 + 2 h 2 o
Pri grijanju, hlorid je oksidiran kisikom (katalizator - CoCL 2 hlorid (II) 2):
4 HCL + O 2 → 2 h 2 O +2 CL 2
Međutim, koncentrirana hlorovodonska kiselina reagira sa bakrom, formiran je kompleks monovalentnog bakra:
2 CU + 4 HCL → 2 H + H 2
Mješavina 3 dijela zapremine koncentriranog hidroklorika i 1 zapremine koncentriranih dušičnih kiselina naziva se "Tsarist votkom". Kraljevska votka može rastopiti čak i zlato i platinu. Visoka oksidativna aktivnost Kraljevske votke nastala je zbog prisustva azota i hlor hlorida u njemu, koja su u ravnoteži sa izvornim tvarima:
4 h 3 O + + 3 CL - + NO 3 - \u003d NOCL + CL 2 + 6 H 2 O
Zbog velike koncentracije jona hlorida u otopinu, metal je povezan sa hloridnim kompleksom, što doprinosi njenom raspuštanju:
3 pt + 4 HNO 3 + 18 HCL → 3 h 2 + 4 NO + 8 H 2 o
Za Chloroodor, karakteristična je i reakcija na više odnosa (elektrofilska veza):
R-CH \u003d CH 2 + HCL → R-CHCL-CH 3
R-C≡CH + 2 HCL → R-CCL 2 -CH 3
Klor oksidi - neorganska hemijska jedinjenja hlora i kisika, opća formula: CL X O.
Klor formira sljedeće okside: CL 2 O, CL 2 O 3, CLO 2, CL 2 O 4, CL 2 O 6, CL 2 O 7. Pored toga, kratkotrajni klo radikal, radikal hlor hlora i radikalnog klorskog tetraoksida CLO 4 radikal.
Ispod tabele prikazuje svojstva stabilnih klor oksida:
Tabela 6.
| Nekretnina | CL 2 O. | CLO 2. | CLOCLO 3. | CL 2 O 6 (G) ↔2clo 3 (G) | CL 2 O 7 |
| Boja i stanje sa krevetima. Temperatura | Sivo-smeđi gas | Sivo-zeleni gas | Svijetlo žuta tečnost | Tamno crvena tečnost | Bezbojna tečnost |
| Stupanj oksidacijskog hlora | (+1) | (+4) | (+1), (+7) | (+6) | (+7) |
| T. pl., ° C | −120,6 | −59 | −117 | 3,5 | −91,5 |
| T. Kip., ° C | 2,0 | 44,5 | |||
| d. (F, 0 ° C), g * cm -3 | - | 1,64 | 1,806 | - | 2,02 |
| ΔH ° org (Gaz, 298 K), KJ * MOL -1 | 80,3 | 102,6 | ~180 | (155) | |
| ° ° CPA (Gaz, 298 K), KJ * MOL -1 | 97,9 | 120,6 | - | - | - |
| S ° ORG (GAZ, 298 K), J * K -1 * MOL -1 | 265,9 | 256,7 | 327,2 | - | - |
| Dipolni trenutak μ, D | 0,78 ± 0,08 | 1,78 ± 0,01 | - | - | 0,72 ± 0,02. |
 Klor oksid (i), Dichlorov oksid, hlorotički animid anhidrid - klor spoj u oksidacijski stupanj sa kisikom.
Klor oksid (i), Dichlorov oksid, hlorotički animid anhidrid - klor spoj u oksidacijski stupanj sa kisikom.
U normalnim uvjetima, to je smeđi-žuti gas s karakterističnim mirisom koji nalikuje miris klora. Na temperaturama ispod 2 ° C - zlatno-crvena tečnost. Otrovno: udara za respiratorni trakt. Spontano polako raspada:
Na velikim koncentracijama su eksplozivni. Gustina u normalnim uvjetima 3,22 kg / m³. Rastvara u četverokloridnom ugljiku. Dobro rastvovan u vodi sa formiranjem slabe Chlornoćke kiseline:
Brzo reagira s alkalisom:
CL 2 O + 2AOH (RSC) \u003d 2Naclo + H 2 o
Hlor dioksid - Kiseli oksid. Kada se rastvaraju u vodi, klorid i hlorirana kiselina (reakcija neproporcionalne). Razblažena rješenja otporna su u mraku, svjetlost se polako razgrađuje:
 Hlor dioksid - Klor oksid ( IV.), sloj hlora i kisika, formula: CLO 2.
Hlor dioksid - Klor oksid ( IV.), sloj hlora i kisika, formula: CLO 2.
U normalnim uvjetima CLO 2 je crvenkasto-žuti plin, sa karakterističnim mirisom. Na temperaturama ispod 10 ° C CLO 2 je crveno-smeđa tečnost. Nepradno otporno, eksplodira na svjetlo tokom kontakata sa oksidantima i prilikom zagrevanja. Dobro rastvorljiv u vodi. Zbog eksplozivnosti hlor-dioksida, nemoguće je pohraniti u obliku tečnosti.
Kiseli oksid. Kada se rastvaraju u vodi, klorid i hlorirana kiselina (reakcija neproporcionalne). Razblažena rješenja otporna su u mraku, svjetlost se polako razgrađuje:
Rezultirajuća kloridna kiselina je vrlo nestabilna i razgrađena:
Prikazuje Redox svojstva.
2clo 2 + 5h 2 SO 4 (RSC) + 10Feso 4 \u003d 5FE 2 (SO 4) 3 + 2HCL + 4H 2 O
CLO 2 + 2NAOH HOT. \u003d Naclo 2 + naclo 3 + h 2 o
CLO 2 + O 3 \u003d CLO 3 + O 2
CLO 2 reagira s mnogim organskim spojevima i obavlja oksidirajuće sredstvo srednje sile.
 Chlornaninska kiselina - HCLO, vrlo slaba monosokond kiselina u kojem hlor ima stepen oksidacije +1. Postoji samo rješenja.
Chlornaninska kiselina - HCLO, vrlo slaba monosokond kiselina u kojem hlor ima stepen oksidacije +1. Postoji samo rješenja.
U vodenim rješenjima, klorotna kiselina djelomično se raspada na protonu i hipohlorit-anion CLO -:
Nestabilno. Chlornanotska kiselina i njegova sol - hipohloritet - Jaki oksidizeri. Reagira sa HCL hidroloričnom kiselinom, formirajući molekularni hlor:
Hclo + naoh (RSC) \u003d naclo + h 2 o 
Nejažna kiselina - HCLO 2, jednoosna kiselina srednje snage.
Kloridna kiselina NCLO 2 u slobodnom obliku nestabilnog, čak i u razblaženoj vodenoj otopini, brzo se raspada:
Neutraliziran od Alkalis.
Hclo 2 + naoh (RSC. Vruće.) \u003d Naclo 2 + h 2 o
Anhidrid ove kiseline nije poznat.
Kisela rješenje dobiva se iz svojih soli - hloritProitirajući iz interakcije CLO 2 sa nagibom:
Brisanje redox svojstava.
5hclo 2 + 3h 2 So 4 (RSC) + 2kmno 4 \u003d 5hclo 3 + 2MNSO 4 + K 2 SO 4 + 3H 2 O
 Hlorna kiselina - HCLO 3, jaka monosokond kiselina u kojem hlor ima stepen oksidacije +5. Besplatan oblik se ne dobija; U vodenim rješenjima u koncentraciji ispod 30% u hladnoći je prilično stabilna; U koncentriranim rješenjima raspada:
Hlorna kiselina - HCLO 3, jaka monosokond kiselina u kojem hlor ima stepen oksidacije +5. Besplatan oblik se ne dobija; U vodenim rješenjima u koncentraciji ispod 30% u hladnoći je prilično stabilna; U koncentriranim rješenjima raspada:
CHLORNIČKA KISEA - Snažan oksidant; Oksidativni kapacitet se povećava sa povećanjem koncentracije i temperature. HCLO 3 se lako vraća u klorovodoničnu kiselinu:
HCLO 3 + 5HCL (CONC.) \u003d 3CL 2 + 3H 2 O
Hclo 3 + naoh (spz.) \u003d Naclo 3 + h 2 o
Kad se mješavina tako i zraka prolazi kroz snažno kiselo rješenje, formira se hlor dioksid:
U 40% klorinskoj kiselinom plamenu, na primjer, filter papir.
8. Pronalaženje prirode:
U Zemljinom kore kloru je najčešći halogen. Budući da je hlor vrlo aktivan, u prirodi se nalazi samo u obliku spojeva u mineralima.
Tabela 7. Pronalaženje prirode
Tabela 7. Mineralni oblici
Najveće rezerve hlora sadržane su u sastavu soli mora i okeana.
Dobivanje
Hemijske metode za proizvodnju hlora su neefikasne i troškovne. Do danas su uglavnom istorijski značaj. Može se dobiti u interakciji kalijuma permanganate sa hidrokloronom kiselinom:
Sheel metoda
U početku je industrijska metoda za dobijanje hlora zasnovana na metodi Shelela, odnosno piro-hidrokloridne reakcije sa hidroukloronom kiselinom:
Dicon metoda
Metoda za proizvodnju hlora s katalitičkom oksidacijom klizača Chloroodore Air kisik.
Elektrohemijske metode
Danas se hlor na industrijskom nivou dobija zajedno sa natrijum hidroksidom i vodonik elektrolizom otopine natrijum soli, čiji se glavni procesi mogu podnijeti ukupnom formulom:
Primjena
· Profil prozora napravljen od polimera koji sadrže hlora
· Glavna komponenta izbežavanja je Labarracova voda (natrijum hipohlorit)
· U proizvodnji polivinil hlorida, plastike, sintetičke gume.
· Izrada hlorrorganskih. Značajan dio proizvedenog klora troši se na alate za zaštitu bilja. Jedan od najvažnijih insekticida je heksahlorcyclohexane (često se naziva heksaklororan).
· Koristi se kao borbena trovanja supstanca, kao i za proizvodnju drugih borbenih tvari za otrovanje: IPRIT, fosgen.
· Da biste dezinficirali vodu - "hloriranje".
· Prehrambena industrija je registrovana kao dodatak prehrani E925.
· U hemijskoj proizvodnji hlorovodonične kiseline, kreč za hlor, bertolen sol, metalni hloridi, otrovi, lijekovi, gnojiva.
· U metalurgiji za proizvodnju čistih metala: titanijum, limenka, tantalum, niobijum.
· Kao pokazatelj solarnih neutrina u detektorima hlora-argona.
Mnoge razvijene zemlje nastoje ograničiti upotrebu hlora u svakodnevni život, uključujući i sagorijevanjem smeća koji sadrže hlor, formira se značajna količina dioksina.
Klor je vjerojatno dobio više alkemičara, ali njegovo otkriće i prvo studiranje bilo je neraskidivo povezano s imenom poznatog švedskog hemičara Karl Wilhelm Shelele. Shelele je otvorila pet hemijskih elemenata - barijum i mangan (zajedno sa Yuhan Gan), molibdenom, volfram, hlorom i bez obzira na ostale hemičare (iako kasnije) - tri više: kisik, vodonik i azot. Ovo postignuće je naknadno ne moće ponoviti nemama hemičara. Istovremeno, Shelele, koja je već izabrala članica švedske kraljevske akademije nauka, bila je jednostavan ljekarnik u valjenju, iako bi mogao uzeti časniji i prestižniji položaj. Friedrich II Sjajan sam, Prussanski kralj, ponudio mu je da preuzme mesto profesora hemije u Berlinu. Odbijajući takve primamljive prijedloge, Syel je rekao: "Ne mogu jesti više nego što trebam, a ono što ovdje zaradim u valjenju, imam dovoljno za hranu."
Mnogobrojne jedinjenja hlora bile su poznate, naravno, dugo pred Shelele. Ovaj element je dio mnogih soli, uključujući najpoznatiju - sol stol. 1774, Shelele je označavao hlor u slobodnom obliku, grijanje crne mineralne piroluzije sa koncentriranom hlorovodoničnom kiselinom: MNO 2 + 4HCL ® CL 2 + MNCL 2 + 2H 2 O.
U početku su hemičari smatrali da hlor ne kao element, već kao hemijsku jedinjenje nepoznatog elementa Muria (sa latinske Murijske - slane) sa kisikom. Vjeruje se da se vjerovalo da se hidroholorična kiselina (zvanu mural) sadrži hemijski vezani kisik. Ovaj "svjedočio", posebno, takav činjenica: Kada se hlorovo rješenje stoji, kiseonik je pušten iz nje, a hidroklorona kiselina ostala je u rješenju. Međutim, brojni pokušaji "oduzetog" kiseonika iz klora nisu doveli do bilo čega. Dakle, niko nije uspio dobiti ugljični dioksid, grijati hlor sa ugljem (koji na visokim temperaturama "izvadi" kiseonik iz mnogih spojeva koji ih sadrže). Kao rezultat takvih eksperimenata koje je proveo Gemphri Davy, Joseph Louis Gay-Louusak i Louis Jacques Tenar, postao je jasan da hlor ne sadrži kiseonik i jednostavna je supstanca. Pored toga, eksperimenti su vodili eksperimente gay-loussaka koji su analizirali kvantitativni omjer plinova u reakciji hlora s vodonik.
Davy je 1811. godine predložio ime "hlorin" za novi element - od grčkog. "Chloros" je žuto-zeleno. Takva je boja koja ima hlor. Isti korijen je u riječi "klorofil" (od grčkog. "Chloros" i "Phillon" - list). Godinu dana kasnije Gay Lusški "presekao je" ime hloru. Ali tako daleko britanci (i Amerikanci) nazivaju se ovaj element "hlor" (hlor), dok su francuski hlor (Chlore). Prihvatite skraćeno ime i Nijemce - "zakonodavci" hemije u skoro samo 19 V. (Njemački hlor - Chlor). Godine 1811. njemački fizičar Johann Schweiher predložio je ime "Halogen" za hlor (iz grčke "hals" - sol i "gennao" - rađanje). Nakon toga, ovaj termin je ukorio ne samo za hlor, već i za sve svoje analoge prema sedmoj grupi - fluor, bromin, jod, asstat.
Demonstracija sagorevanja vodika u atmosferi hlora je zanimljiva: ponekad se pojavljuje neobična nuspojava tokom iskustva: čuje se Buzz. Najčešće se plamen zuji kada se tanka cijev hrani vodikom, spušta se u posudu konutog oblika ispunjenog klorom; Isto vrijedi i za sferne tikvice, ali u cilindrima se plamen obično ne zuja. Ovaj fenomen se nazivao "plamen sjetve".
U vodenom otopinu, hlor je djelomično i prilično polako reagira s vodom; Na 25 ° C, ravnoteža: CL 2 + H 2 o HCLO + HCL instalirana je dva dana. Chvojane kiseline u svjetlu se raspada: HCLO ® HCL + O. To je atomski kisik koji atributi izbjeljivanje (apsolutno suhi hlor ne posjeduje takvu sposobnost).
Klor u svojim spojevima može pokazati sve stupnjeve oksidacije - od -1 do +7. Sa klornim kisikom formira seriju oksida, oni su u čistom obliku nestabilni i eksplozivni: CL 2 O je žuto-narandžasti plin, CLO 2 - žuti plin (ispod 9,7 ° C - svijetlo-boja tečnost), hlorira CL 2 O 4 (CLO -CLO 3, svijetlo žuta tečnost), CL 2 O 6 (O 2 CL-O-CLO 3, svijetla crvena tečnost), CL 2 O 7 - bezbojna vrlo eksplozivna tečnost. Na niskim temperaturama dobivena su nestabilna CL 2 O 3 i CLO 3 oksida. CLO 2 oksid se proizvodi na industrijskoj vaga i koristi se umjesto hlora za izbjeljivanje celuloze i dezinfekciju pitke vode i kanalizacije. Uz ostale halogene, hlor formira niz takozvanih međudegenih spojeva, na primjer, CLF, CLF 3, CLF 5, BRCL, ICL, ICL 3.
Hlor i njegovi spojevi sa pozitivnim stepenom oksidacije su jaki oksidizeri. 1822. njemački hemičar Leopold Gmelin oksidirajući hlor iz žute krvne soli: 2k 4 + CL 2 ® K 3 + 2kcl. Klor lako oksidira bromid i hloride sa besplatnim oblikom broma i joda.
Hlor u različitim oksidacijskim stupnjevima: HCl - hlorid (sol, soli - hloridi), hclo - kloriste (soli - hloride), hclo 3 - hlor (soli - hlor) , HCLO 4 - hlor (soli - perhlorati). U čistom obliku kiseoničkih kiselina, samo je klor stabilan. Iz soli kiseoničkih kiselina. Praktične aplikacije imaju hipohlorete, natrijum-hlorit naclo 2 - za izbeljujuće tkive, za proizvodnju kompaktnih pirotehničkih izvora kisika ("kisik sol), kalcijum i magnezijum (za borbu protiv poljoprivrede) štetočine, kao komponente pirotehničkih kompozicija i eksploziva, u proizvodnji mečeva), perhlorate - komponente eksploziva i pirotehničkih kompozicija; Amonijum perchlorat je komponenta solidnih raketnih goriva.
Hlor reagira s mnogim organskim spojevima. Brzo se pridružuje nezasićenim spojevima sa dvostrukim i trostrukim ugljičnim obveznicama (reakcija acetilena ide s eksplozijom), a u svjetlu - i na benzenu. Pod određenim uvjetima, hlor može zamijeniti atome vodika u organskim spojevima: R-H + CL 2 ® RCL + HCl. Ova reakcija igrala je značajnu ulogu u istoriji organske hemije. 1840-ih, francuski hemičar Jean Batiste Duma otkrila je da je pod djelovanjem hlora na sirćetnu kiselinu s nevjerojatnom lakoćom, postoji reakcija
CH 3 Soam + CL 2 ® CH 2 CLCOOH + HCL. Uz višak hlora, formirana je trihloroacetska kiselina SL 3 Coxy. Međutim, mnogi su hemičari reagirali u Dumi nevjerojatno. Doista, prema općenito prihvaćenim, teorija Berceliusa, pozitivno naplaćena atoma vodika ne mogu se zamijeniti negativnim nabijenim klorima atoma. Ovo se mišljenje pridržavalo se mnogim izvanrednim kemičarima, među kojima su bili Friedrich Völer, Yustus Libih i, naravno, Bercelius sam.
Da biste se ismijavali Dumas, Vyler je svom prijatelju Libiha dao članak u ime nekih Schwindlera (Schwindler - u njemačkom prevarantu) o novoj uspješnoj primjeni navodno otvorenu reakciju dume. U članku, Vyler sa očiglednim zamkama pisao je o tome kako se u manganu zaikovitim actietinom (CH 3) upravljaju svim elementima, u skladu sa svojom valence, što je rezultiralo žutom kristalnom supstancom sama. Rečeno je da u Engleskoj svi atomi na atomima hlora u organskim spojama u organskim spojevima, konvencionalni tkiva pretvaraju se u hlor, a to, dok stvari zadržavaju svoj izgled. Fusnota je navedena da se trgovine u Londonu trguje materijal koji se sastoji od jednog hlora, jer je ovaj materijal vrlo dobar za noćne kape i tople atribute.
Reakcija hlor sa organskim spojevima dovodi do stvaranja skupora hlorganskih proizvoda, među kojima su široko korišteni otapala metilena hlorida CH 2 CL 2, hloroform chcl 3, ccl četiri klorid hlorida, trihloretilena chcl \u003d CCL 2, tetrahlorethilena C 2 CL 4. U prisustvu vlage, hlor razblažio zeleni listove biljaka, mnogo boja. To se još koristilo u XVIII veku. Za izbjeljivanje tkanine.
Hlor kao trovanje plinom.
Klor Shelena proslavila je svoj neugodan oštar miris, poteškoće u disanje i kašalj. Kao kasnije, osoba osjeća miris hlora čak i ako u litri zraka sadrži samo 0,005 mg ovog plina, a istovremeno ima nadražujuće učinak na respiratorni trakt, uništavajući ćelije sluznice respiratornog trakt i pluća. Koncentracija 0,012 mg / l nosi se s poteškoćama; Ako koncentracija hlora prelazi 0,1 mg / l, postaje opasna po život: disanje je skupo, postaje konvulzivno, a onda je sve rijetko, a nakon 5-25 minuta dolazi do toga. Najvećih dopuštenih u zraku industrijskih preduzeća je koncentracija 0,001 mg / l, a u zraku stambenih područja - 0,00003 mg / l.
Petersburg akademik Tovi Egorovich Lovitz, ponavljajući se u 1790. iskustvo Shelele, slučajno je objavio značajnu količinu hlora u zrak. Inspirati ga, izgubio je svijest i pao, a zatim osam dana patilo od bolne boli u grudima. Srećom, oporavio se. Skoro da sam umrla, dostigao klor, a poznati engleski hemičar Davy. Eksperimenti čak i sa malom količinom hlora opasni su, jer mogu izazvati ozbiljnu štetu pluća. Kaže se da je njemački hemičar Eaga Vieberg jedan od njegovih predavanja na hloru počeo riječima: "Hlor je otrovni plin. Ako se izlijem tokom sljedeće demonstracije, odnesite me, molim vas, na svježem zraku. Ali predavanje istovremeno će se morati prekinuti. " Ako pustimo puno hlora u zrak, postaje prava katastrofa. To je iskusilo anglo-francuske trupe tokom Drugog svjetskog rata. Ujutro 22. aprila 1915. godine, njemačka komanda odlučila je da drži prvi napad na plin u istoriji ratova: kada je vjetar puhao u stranu neprijatelja, na malom šestometarskom dijelu prednje strane u području Belgijski grad IPRS, 5730 ventila cilindra otvoren je u isto vrijeme, od kojih je svaki sadržavao 30 kg tečnog hlora. U roku od 5 minuta, formiran je ogroman žuto-zeleni oblak, koji je polako napustio njemačke rovove prema saveznicima. Britanski i francuski vojnici pokazali su se potpuno nebrojenim. Gas je prodro u pukotine u sva skloništa, od njega nije bilo spasenja: jer plinska maska \u200b\u200bjoš nije izmišljena. Kao rezultat toga, 15 hiljada ljudi je otrovalo, od čega 5 hiljada - do smrti. Za mjesec dana, 31. maja, Nijemci su ponovili napad na plin na istočnoj frontu - protiv ruskih trupa. Dogodilo se u Poljskoj u gradu Bolimovu. Na prednjem dijelu 12 km od 12 hiljada cilindara, pušteno je 264 tone smjese hlora s znatno više otrovnijim fosgenom (ugljena hlorida COCLD 2). Kraljevska komanda znala je o onome što se dogodilo tokom IPR-a, i ipak, ruski vojnici nisu imali sredstva za zaštitu! Kao rezultat napada plina, gubitak je iznosio 9146 ljudi, od čega je samo 108 bio rezultat puške i artiljerijskog granatiranja, ostalo je otrovan. Istovremeno, 1183 ljudi je umrlo gotovo odmah.
Ubrzo su hemičari pokazali kako pobjeći sa hlora: Potrebno je disati kroz zavoj u gazu impregniranim otopinom natrijum tiosulfate (ova supstanca se koristi na fotografiji, često se naziva hiposulfit). Hlor vrlo brzo reagira s otopinom tisulfata, oksidirajući:
Na 2 S 2 o 3 + 4cl 2 + 5h 2 O ® 2H 2 SO 4 + 2Nacl + 6HCL. Naravno, sumporna kiselina također nije bezopasna supstanca, ali njegova razrjeđena vodena otopina mnogo je manje opasna od otrovnog hlora. Stoga se tiosulfat u tim godinama pojavio drugo ime - "Antichlor", ali prve tisulfatne plinske maske bile su malo efikasne.
1916. godine, ruski hemičar, budući akademik Nikolaj Dmitrievich Zelinsky izmislio je zaista efikasnu gasnu masku, u kojoj su otrovne tvari pritvorene slojem aktiviranog uglja. Takav ugljen s vrlo razvijenom površinom mogao bi odgoditi mnogo više hlora nego gaza impregnirana hipozulfitom. Srećom, "napadi hlora" ostali su samo tragična epizoda u historiji. Nakon svjetskog rata, hlor je imao samo mirne profesije.
Upotreba hlora.
Svake godine postoje ogromne količine hlora - desetine miliona tona. Samo u Sjedinjenim Državama do kraja 20. vijeka. Svake godine, oko 12 miliona tona hlora dobiveno je elektrolizom (10. mjesto među hemijskim industrijama). Njegova glavna masa (do 50%) troši se na hloriranje organskih spojeva - za dobivanje otapala, sintetičke gume, polivinil hlorida i druge plastike, hloroprenske gume, pesticide, druge potrebne i korisne proizvode. Ostalo se konzumira za sintezu anorganskih klorida, u industriji pulpe i papira za izbjeljivanje drvene kasele, za pročišćavanje vode. U relativno malim količinama, hlor se koristi u metalurškoj industriji. S njom se dobivaju vrlo čisti metali - titanijum, limenka, tantalum, niobijum. Izgaranje vodika u hloru dobiva se kloridom, a iz nje se dobiva hidroklorona kiselina iz nje. Klor se koristi i za proizvodnju tvari za izbjeljivanje (hipohlorita, klor lipa) i vodene dezinfekcije sa kloriranjem.
Ilya Leanson
Glavna industrijska metoda pribavljanja je koncentrirani naCl (Sl. 96). Istovremeno se pušta (2SL '- 2E- \u003d CL 2), a u katodnom prostoru (2n · + 2e - \u003d h 2) pušta i formira NaOH.
Sa laboratorijom koji dobiva obično koristi akciju MNO 2 ili KMNO 4 na:
MNO 2 + 4nSL \u003d MNSL 2 + CL 2 + 2N 2
2kmno 4 + 16nsl \u003d 2xl + 2mnsl 2 + 5sl 2 + 8h 2 o
Njenom karakterističnom hemijskom funkcijom, to je i aktivan monolentno metaloid. Međutim, manje je od toga. Stoga, potonji može nadmašiti iz spojeva.
Interakcija sa softverom H 2 + CL 2 \u003d 2HCL + 44 kcal
u normalnim uvjetima, izuzetno se polako, ali kada se mješavina zagrijava ili njegova jaka svjetlost (direktna sunčeva svjetlost, paljenje itd.) Prati.
Nacl + H 2 SO 4 \u003d NAHSO 4 + HCL
Nacl + nahso 4 \u003d na 2 so 4 + hcl
Prvi od njih dijelom se nastavlja u normalnim uvjetima i praktički usmjeren na nisko grijanje; Drugi se vrši samo višim. Za proces mehaničke velike performanse služe.
CL 2 + H 2 O \u003d HCL + NOSL
Budući da je nestabilna veza, nos se polako raspada čak i u tako razblaženom. Nazvana klorotna kiselina, ili. Sam nos i vrlo je jak.
Da bi se to postigao najlakši način dodavanja reakcijskoj smjesi. Budući da će, kao što se nalazi, bit će povezan s pravom. Korištenje, na primjer, NaOH ima:
CL 2 + H 2 O<–––> Nosl + hcl.
Hocl + nsl + 2naoh ---\u003e naocl + nacl + 2h 2 o
ili uopšte:
CL 2 + 2NAOH ---\u003e NAOCL + NACL + N 2
Kao rezultat interakcije, ispada se, dakle, mješavina klorithe i. Forming (") ima jaku oksidativna svojstva i široko se koristi za izbeljivanje i.
1) nos \u003d nsl + o
2) 2'SL \u003d H 2 O + SL 2
3) 3hocl \u003d 2ncl + nslo 3
Svi ovi procesi mogu se istovremeno postupiti, ali njihove relativne brzine su uvelike ovisne o postojećim uvjetima. Promjenom potonjeg moguće je osigurati da transformacija će ići gotovo usmjeriti u neki smjer.
Pod djelovanjem izravne raspadanje sunčeve svjetlosti ide na prvu od njih. To se takođe teče u prisustvu lako pričvršćivanja, a neki (na primjer, ").
Dezintegracija nosa u trećem vrstu posebno je lagana kada se zagrijava. Stoga se radnja na vrućima izražava ukupnom jednadžbom:
ZSL 2 + 6CON \u003d KCLO 3 + 5XL + 3N 2 O
2xlo 3 + H 2 C 2 O 4 \u003d K 2 CO 3 + CO 2 + H 2 O + 2CLO 2
formiran je zelenkasto-žuto dioksid (pl. - 59 ° C, t. Kip + 10 ° C). Besplatni CLO 2 sa niskim otpornim i može se raspasti