क्लोरीन रासायनिक गुण। क्लोरीन प्राप्त करने के क्लोरीन तरीके। पानी और जलीय क्षार समाधान में अनुपातहीन क्लोरीन
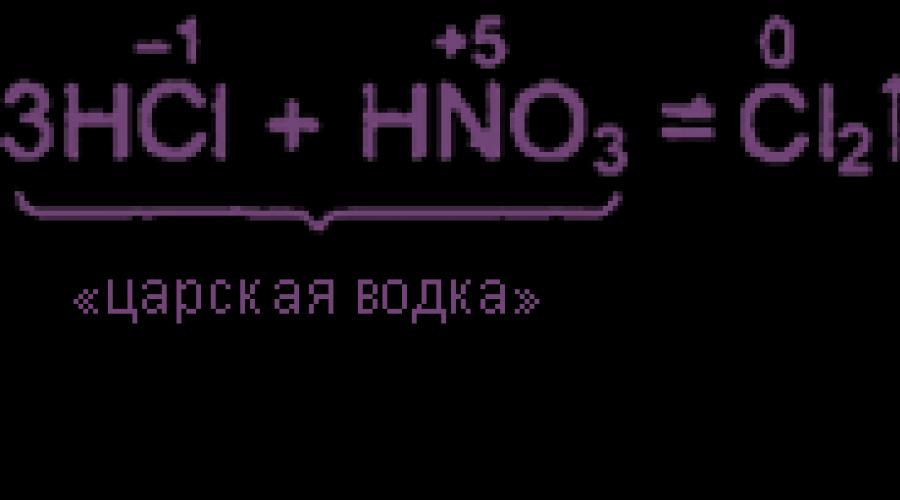
परिभाषा
क्लोरीन - रासायनिक तत्व VII समूह 3 रासायनिक तत्वों की आवधिक प्रणाली डीआई। Mendeleeve। गैर धातु।
तत्वों को संदर्भित करता है - पी-परिवार। हलोजन। सीरियल नंबर - 17. बाहरी इलेक्ट्रॉनिक स्तर की संरचना 3 एस 2 3 पी 5 है। सापेक्ष परमाणु द्रव्यमान - 35.5 एईएम। क्लोरीन अणु डबल - सीएल 2।
रासायनिक गुण क्लोरीन
क्लोरीन सरल धातुओं के साथ प्रतिक्रिया करता है:
सीएल 2 + 2 एसबी \u003d 2 एसबीसीएल 3 (टी);
सीएल 2 + 2FE \u003d 2FECL 3;
सीएल 2 + 2 एनए \u003d 2nacl।
क्लोरीन सरल गैर-धातु पदार्थों के साथ बातचीत करता है। इस प्रकार, फास्फोरस और सल्फर के साथ बातचीत करते समय, उचित क्लोराइड का गठन होता है, फ्लोराइड के साथ - फ्लोराइड्स, हाइड्रोजन - क्लोराइड हाइड्रोजन के साथ, ऑक्सीजन - ऑक्साइड इत्यादि के साथ।:
5CL 2 + 2P \u003d 2HCL 5;
सीएल 2 + 2 एस \u003d एससीएल 2;
सीएल 2 + एच 2 \u003d 2 एचसीएल;
सीएल 2 + एफ 2 \u003d 2CLF।
क्लोरीन हाइड्रोजन और धातुओं के साथ अपने यौगिकों से ब्रोमाइन और आयोडीन को विस्थापित करने में सक्षम है:
सीएल 2 + 2 एचबीआर \u003d बीआर 2 + 2 एचसीएल;
सीएल 2 + 2nai \u003d i 2 + 2nacl।
क्लोरीन पानी और क्षारों में भंग करने में सक्षम है, जबकि क्लोरीन असमानता की प्रतिक्रिया होती है, और प्रतिक्रिया उत्पादों की संरचना इसकी स्थितियों पर निर्भर करती है:
सीएल 2 + एच 2 ओ ↔ एचसीएल + एचसीएलओ;
सीएल 2 + 2NAOH \u003d NACL + NACLO + H 2 O;
3 सीएल 2 + 6NAOH \u003d 5NACL + NACLO 3 + 3H 2 O.
क्लोरीन गैर-बनाने वाले ऑक्साइड के साथ बातचीत करता है - एक छोटे से नाम के साथ पदार्थ के गठन के साथ - फॉस्जिन, अमोनिया के साथ अमोनियम ट्राइक्लोराइड बनाने के लिए:
सीएल 2 + सीओ \u003d कोल 2;
3 सीएल 2 + 4 एनएच 3 \u003d एनसीएल 3 + 3 एनएच 4 सीएल।
प्रतिक्रियाओं में, क्लोरीन ऑक्सीडेंट के गुण दिखाता है:
सीएल 2 + एच 2 एस \u003d 2 एचसीएल + एस।
क्लोरीन एल्केन, एलकेन्स और एरेना के वर्ग के कार्बनिक पदार्थों के साथ बातचीत की प्रतिक्रिया में प्रवेश करता है:
सी 3-सी 3 + सीएल 2 \u003d सीएच 3-सीएच 2 -सीएल + एचसीएल (हालत - यूवी विकिरण);
सीएच 2 \u003d सीएच 2 + सीएल 2 \u003d सीएच 2 (सीएल) -च 2 -सीएल;
सी 6 एच 6 + सीएल 2 \u003d सी 6 एच 5 -सीएल + एचसीएल (कैट \u003d एफईसीएल 3, एलसीएल 3);
सी 6 एच 6 + 6 एल 2 \u003d सी 6 एच 6 सीएल 6 + 6 एचसीएल (हालत - यूवी विकिरण)।
भौतिक गुण क्लोरीन
क्लोरीन - पीला-हरी गैस। सक्रिय रूप से स्थिर। क्लोराइड क्लोरीन के साथ संतृप्त होने पर, एक ठोस क्राट बनता है। यह पानी में अच्छी तरह से घुलनशील है, विघटन ("क्लोरीन पानी") काफी हद तक काफी हद तक उजागर है। कार्बन टेट्राक्लोराइड भंग हो गया है, तरल एसआईसीएल 4 और टीआईसीएल 4। सोडियम क्लोराइड के एक संतृप्त समाधान में खराब रूप से भंग। ऑक्सीजन के साथ प्रतिक्रिया नहीं करता है। मजबूत ऑक्सीडाइज़र। उबलते बिंदु - -34.1 सी, पिघलने - -101,03 सी।
क्लोरीन प्राप्त करना
पहले, क्लोरीन को शेली की विधि (हाइड्रोक्लोरिक एसिड के साथ मैंगनीज ऑक्साइड (छठी) की बातचीत की प्रतिक्रिया) या डीआईसीओएन विधि (ऑक्सीजन के साथ क्लोरूडोर की बातचीत की प्रतिक्रिया) द्वारा प्राप्त की गई थी:
एमएनओ 2 + 4 एचसीएल \u003d एमएनसीएल 2 + सीएल 2 + 2 एच 2 ओ;
4 एचसीएल + ओ 2 \u003d 2 एच 2 ओ + 2 सीएल 2।
आजकल, क्लोरीन प्राप्त करने के लिए निम्नलिखित प्रतिक्रियाओं का उपयोग किया जाता है:
NAOCL + 2HCL \u003d NACL + CL 2 + H 2 o;
2 केएमएनओ 4 + 16 एचसीएल \u003d 2 केसीएल + 2 एमएनसीएल 2 +5 सीएल 2 + 8 एच 2 ओ;
2nacl + 2h 2 o \u003d 2naoh + cl 2 + एच 2 (हालत - इलेक्ट्रोलिसिस)।
क्लोरीन का उपयोग
उद्योग के विभिन्न क्षेत्रों में क्लोरीन का व्यापक रूप से उपयोग किया जाता है, इसलिए इसका उपयोग पॉलिमरिक सामग्री (पॉलीविनाइल क्लोराइड), ब्लीचिंग, क्लोरोरोगनिक कीटनाशकों (हेक्सहोरनरन), पानी कीटाणुशोधन के लिए, खाद्य उद्योग में पानी कीटाणुशोधन के लिए लड़ाकू विषाक्तता (फॉस्जीन) के उत्पादन में किया जाता है, धातु विज्ञान आदि में
समस्याओं को हल करने के उदाहरण
उदाहरण 1।
उदाहरण 2।
| कार्य | क्या वॉल्यूम, द्रव्यमान और क्लोरीन पदार्थ की मात्रा को हाइलाइट किया गया है (एन.यू.) हाइड्रोक्लोरिक एसिड के 17.4 ग्राम के 17.4 ग्राम (iv) की बातचीत के साथ अधिक में लिया गया है? |
| फेसला | हम हाइड्रोक्लोरिक एसिड के साथ मैंगनीज ऑक्साइड (iv) की बातचीत की प्रतिक्रिया के समीकरण को लिखते हैं: 4 एचसीएल + एमएनओ 2 \u003d एमएनसीएल 2 + सीएल 2 + 2 एच 2 ओ। मैंगनीज ऑक्साइड (iv) और क्लोरीन के दाढ़ी के लोगों ने रासायनिक तत्वों की तालिका का उपयोग करके गणना की। Mendeleeve - 87 और 71 जी / एमओएल क्रमशः। मंगैंड ऑक्साइड की मात्रा की गणना करें (iv): n (mno 2) \u003d m (mno 2) / m (mno 2); n (mno 2) \u003d 17.4 / 87 \u003d 0.2 मोल। प्रतिक्रिया समीकरण एन (एमएनओ 2) के अनुसार: एन (सीएल 2) \u003d 1: 1, इसलिए, एन (सीएल 2) \u003d एन (एमएनओ 2) \u003d 0.2 मोल। फिर क्लोरीन का द्रव्यमान और मात्रा बराबर होगी: एम (सीएल 2) \u003d 0.2 × 71 \u003d 14.2 ग्राम; वी (सीएल 2) \u003d एन (सीएल 2) × वी एम \u003d 0.2 × 22,4 \u003d 4,48 एल। |
| उत्तर | क्लोरीन पदार्थ की मात्रा 0.2 मोल, वजन - 14.2 ग्राम, मात्रा - 4.48 लीटर है। |
के बारे में सीएल 2। टी - पीले-हरी गैस एक तेज चॉपिंग गंध के साथ, हवा से भारी - 2.5 गुना, पानी में पानी में (~ 6.5 ग्राम / एल); एक्स। आर गैर-ध्रुवीय कार्बनिक सॉल्वैंट्स में। बाढ़ केवल ज्वालामुखीय गैसों में पाया जाता है।
प्राप्त करने के तरीके
ऑक्सीकरण की प्रक्रिया के आधार पर सीएल -
2CL - 2E - \u003d CL 2 0
औद्योगिक
क्लोराइड के जलीय समाधानों का इलेक्ट्रोलिसिस, अधिक बार - NACL:
2nacl + 2n 2 o \u003d cl 2 + 2naoh + h 2
प्रयोगशाला
ऑक्सीकरण CONC। एचसीआई विभिन्न ऑक्सीकरण एजेंट:
4 एचसीआई + एमएनओ 2 \u003d सीएल 2 + एमपीसीएल 2 + 2 एन 2 ओ
16NSL + 2KMPO 4 \u003d 5CL 2 + 2MNCL 2 + 2KCL + 8N 2 O
6hcl + kslo 3 \u003d scl 2 + kcl + 3n 2 o
14 एचसीएल + के 2 सीआर 2 ओ 7 \u003d 3 एल 2 + 2 सीआरसीएल 3 + 2 केसीएल + 7 एन 2 ओ
रासायनिक गुण
क्लोरीन एक बहुत मजबूत ऑक्सीकरण एजेंट है। धातु, गैर-धातु और जटिल पदार्थों को ऑक्सीकरण करता है, जो बहुत स्थिर सीएल आयनों में बदल जाता है -:
सीएल 2 0 + 2 ई - \u003d 2CL -
धातुओं के साथ प्रतिक्रियाएं
सूखी गैसीय क्लोरीन के वातावरण में सक्रिय धातुओं को प्रज्वलित और जला दिया जाता है; उसी समय, धातुओं के क्लोराइड का गठन किया जाता है।
सीएल 2 + 2 एन \u003d 2 एनएसीएल
3Cl 2 + 2FE \u003d 2FECL 3
गैर-प्रभावी धातु गीले क्लोरीन या उसके जलीय समाधानों के साथ ऑक्सीकरण करना आसान है:
सीएल 2 + सीयू \u003d सीयूसीएल 2
3Cl 2 + 2AU \u003d 2AUCL 3
गैर-धातुओं के साथ प्रतिक्रियाएं
क्लोरीन सीधे ओ 2, एन 2, सी के साथ बातचीत नहीं करता है। प्रतिक्रिया के अन्य गैर-धातुओं के साथ अलग-अलग स्थितियों के तहत होता है।
Nemmetalov Halides गठित हैं। सबसे महत्वपूर्ण हाइड्रोजन के साथ बातचीत की प्रतिक्रिया है।
सीएल 2 + एच 2 \u003d 2nc1
सीएल 2 + 2 एस (पिघल) \u003d एस 2 सीएल 2
जेडसीएल 2 + 2 आर \u003d 2 पीसी 3 (या पीसीएल 5 - अतिरिक्त सीएल 2 में)
2Cl 2 + SI \u003d SICL 4
3Cl 2 + I 2 \u003d 2ICL 3
अपने यौगिकों से मुक्त गैर-धातुओं (बीआर 2, आई 2, एन 2, एस) को विस्थापित करना
सीएल 2 + 2 केबीआर \u003d बीआर 2 + 2 केसीएल
सीएल 2 + 2KI \u003d I 2 + 2KCL
सीएल 2 + 2Hi \u003d I 2 + 2HCL
सीएल 2 + एच 2 एस \u003d एस + 2 एचसीएल
ZSL 2 + 2NH 3 \u003d N 2 + 6HCL
पानी और जलीय क्षार समाधान में अनुपातहीन क्लोरीन
स्व-सेड्यूजिंग-सेल्फलिंग के परिणामस्वरूप, कुछ क्लोरीन परमाणुओं को सीएल में परिवर्तित कर दिया जाता है, और अन्य ऑक्सीकरण की सकारात्मक डिग्री में अन्य क्लो या क्लॉ 3 आयनों में शामिल होते हैं।
सीएल 2 + एच 2 ओ \u003d एचसीएल + एनसीएलओ Hlornoty k-ta
सीएल 2 + 2कॉन \u003d केसीएल + केसीएलओ + एच 2 ओ
3CL 2 + 6CON \u003d 5KCL + KCLO 3 + 3N 2 O
3Cl 2 + 2s (यह) 2 \u003d CACL 2 + CA (CLO) 2 + 2N 2 O
ये प्रतिक्रियाएं महत्वपूर्ण हैं क्योंकि क्लोरीन ऑक्सीजन यौगिक प्राप्त किए जाते हैं:
केसीएलओ 3 और सीए (सीएलओ) 2 - हाइपोक्लोराइट्स; केसीएलओ 3 - पोटेशियम क्लोरैट (बुर्टुपलेट नमक)।
कार्बनिक पदार्थों के साथ क्लोरीन की बातचीत
ए) अणुओं में हाइड्रोजन परमाणुओं का प्रतिस्थापन
बी) कई कार्बन कार्बन संबंधों को तोड़ने के स्थान पर अणुओं सीएल 2 के अलावा
एच 2 सी \u003d सीएच 2 + सीएल 2 → सीएलएच 2 सी-सीएच 2 सीएल 1,2-डिक्लोरोथेन
HC≡CH + 2CL 2 → सीएल 2 एचसी-सीसीएल 2 1,1,2,2-टेट्राक्लोरोथेन
क्लोराइड और हाइड्रोक्लोरिक एसिड
गैसीय क्लोराइड
भौतिक और रासायनिक गुण
एचसीएल - हाइड्रोजन क्लोराइड। के बारे में टी - beszv। एक तेज गंध के साथ गैस, काफी आसानी से तरलीकृत (टी। -114 डिग्री सेल्सियस, इतनी मेहनत। -85 डिग्री सेल्सियस)। निर्जलीय एचसीएल और गैसीय, और गैर-इलेक्ट्रो-प्रवाहकीय के तरल राज्यों में, धातुओं के धातुओं, ऑक्साइड और हाइड्रोक्साइड के साथ-साथ कई अन्य पदार्थों के संबंध में रासायनिक रूप से निष्क्रिय। इसका मतलब है कि पानी की अनुपस्थिति में, क्लोराइड एसिड गुण नहीं दिखाता है। केवल बहुत उच्च टी गैसीय एचसीएल धातुओं के साथ प्रतिक्रिया करता है, और यहां तक \u200b\u200bकि सीयू और एजी के रूप में भी कम सक्रिय।
एचसीएल में एचपीआरआईडी-आयन के बहाली गुण भी थोड़ी सी डिग्री में प्रकट होते हैं: यह फ्लोराइन द्वारा ऑक्सीकरण किया जाता है। टी, साथ ही साथ उत्प्रेरक की उपस्थिति में उच्च टी (600 डिग्री सेल्सियस) पर प्रतिक्रिया करता है ऑक्सीजन के साथ प्रतिक्रिया करता है:
2 एचसीएल + एफ 2 \u003d सीएल 2 + 2 एचएफ
4 एचसीएल + ओ 2 \u003d 2 एसएल 2 + 2 एन 2 ओ
एचसीएल गैस का व्यापक रूप से कार्बनिक संश्लेषण (हाइड्रोक्लोरीनेशन प्रतिक्रिया) में उपयोग किया जाता है।
प्राप्त करने के तरीके
1. सरल पदार्थों का संश्लेषण:
एच 2 + सीएल 2 \u003d 2 एचसीएल
2. क्लोरिंग एचसी के रूप में यह एक उप-उत्पाद के रूप में बनाया गया है:
आर-एच + सीएल 2 \u003d आर-सीएल + एचसीएल
3. प्रयोगशाला में कंक्रीट द्वारा प्राप्त किया जाता है। एच 2 एसओ 4 क्लोराइड के लिए:
एच 2 एसओ 4 (CONC।) + NACL \u003d 2HCL + NAHSO 4 (कमजोर हीटिंग के साथ)
एच 2 एसओ 4 (कॉन्स।) + 2nacl \u003d 2hcl + na 2 तो 4 (बहुत मजबूत हीटिंग के साथ)
एचसीएल जलीय समाधान - गंभीर एसिड (क्लोराइड, या हाइड्रोक्लोरिक)
एचसीएल पानी में बहुत अच्छी तरह से घुलनशील है: के लिए। टी 1 एल एच 2 ओ ~ 450 लीटर गैस को भंग कर दिया गया है (विघटन के साथ गर्मी की एक महत्वपूर्ण मात्रा की रिहाई के साथ है)। एक संतृप्त समाधान में एचसीएल का द्रव्यमान अंश होता है, जो 36-37% के बराबर होता है। इस समाधान में एक बहुत तेज, घुटन गंध है।
पानी में एचसीएल अणु लगभग आयनों द्वारा लगभग पूरी तरह से विघटित होते हैं, यानी, एचसीएल का एक जलीय घोल एक मजबूत एसिड है।
हाइड्रोक्लोरिक एसिड के रासायनिक गुण
1. पानी में भंग पानी एचसीएल एच + आयनों की उपस्थिति के कारण एसिड के सभी सामान्य गुणों को प्रदर्शित करता है
एचसीएल → एच + + सीएल -
बातचीत:
ए) धातुओं (बीसी) के साथ:
2 एचसीएल 2 + जेएन \u003d जेएनसीएल 2 + एच 2
बी) बुनियादी और एम्फोटेरिक ऑक्साइड के साथ:
2HCL + CUO \u003d CUCL 2 + H 2 o
6HCL + AL 2 O 3 \u003d 2ALCL 3 + ZN 2 O
ग) आधार और एम्फोटेरिक हाइड्रोक्साइड्स के साथ:
2HCL + SA (IT) 2 \u003d CACL 2 + 2N 2 O
3 एचसीएल + अल (यह) 3 \u003d एलएसएल 3 + जेएन 2 ओ
डी) कमजोर एसिड के लवण के साथ:
2HCL + SACO 3 \u003d CACL 2 + CO 2 + H 3 O
एचसीएल + सी 6 एच 5 ओना \u003d सी 6 एन 5 ऑन + एनएसीएल
ई) अमोनिया के साथ:
एचसीएल + एनएच 3 \u003d एनएच 4 सीएल
मजबूत ऑक्सीडाइजिंग एजेंटों के साथ प्रतिक्रिया एफ 2, एमएनओ 2, केएमएनओ 4, केसीएलओ 3, के 2 सीआर 2 ओ 7। आयन सीएल - मुफ्त हलोजन के लिए ऑक्सीकरण:
2CL - 2E - \u003d CL 2 0
प्रतिक्रिया समीकरण "क्लोरीन प्राप्त करना" देखते हैं। विशेष महत्व का हाइड्रोक्लोरिक और नाइट्रिक एसिड के बीच ओएसआर है:

कार्बनिक यौगिकों के साथ प्रतिक्रियाएं
बातचीत:
ए) अमाइन के साथ (कार्बनिक मैदान के रूप में)
आर-एनएच 2 + एचसीएल → + सीएल -
बी) एमिनो एसिड के साथ (एम्फोटेरस कनेक्टिंग के रूप में)

ऑक्साइड और ऑक्सोकस्लोट क्लोरीन
अम्ल ऑक्साइड

अम्ल

सोलोली
रासायनिक गुण
1. सभी क्लोरीन ऑक्सोकॉसल और उनके लवण मजबूत ऑक्सीकरण एजेंट हैं।
2. इंट्रामोल्यूलर ऑक्सीकरण-वसूली या असमानता के कारण हीटिंग के दौरान लगभग सभी यौगिक विघटित होते हैं।

ब्लीचिंग पाउडर
क्लोरीन (बेलन) नींबू - हाइपोक्लोराइट और कैल्शियम क्लोराइड का मिश्रण, एक श्वेत और कीटाणुशोधन प्रभाव है। कभी-कभी इसे मिश्रित नमक का एक उदाहरण माना जाता है, जो एक ही समय में दो एसिड के आयन में अपनी संरचना में:

झवाल पानी।
क्लोराइड और गैपोक्लोराइट पोटेशियम केसीएल + केसीएलओ + एच 2 ओ का जलीय घोल
क्लोरीन के उदाहरण पर मुख्य उपसमूह के VII समूह के तत्वों की विशेषताएं
उपसमूह की सामान्य विशेषताएं
तालिका 1. उपसमूह VIIA के तत्वों का नामकरण
पी-एलिमेंट्स, विशिष्ट, गैर-धातु (अस्थाट - अर्धचिह्न), हलोजन।
इलेक्ट्रॉनिक तत्व चार्ट हेल (एचएएल ≠ एफ):
उपसमूह VIIA के तत्वों के लिए निम्नलिखित वैलेंस द्वारा विशेषता है:
तालिका 2. वैलेंस
3. उपसमूह VIIA के तत्वों के लिए, निम्नलिखित ऑक्सीकरण डिग्री विशेषता है:
तालिका 3. तत्व ऑक्सीकरण डिग्री
रासायनिक तत्व की विशेषता
क्लोरीन - तत्व VII एक समूह। सीरियल नंबर 17।
सापेक्ष परमाणु वजन: 35,4527 ए। ई। मीटर। (जी / एमओएल)
 प्रोटॉन की संख्या, न्यूट्रॉन, इलेक्ट्रॉनों: 17,18,17
प्रोटॉन की संख्या, न्यूट्रॉन, इलेक्ट्रॉनों: 17,18,17
परमाणु संरचना:
![]()
इलेक्ट्रॉनिक सूत्र:
ऑक्सीकरण की विशिष्ट डिग्री: -1, 0, +1, +3, +4, +5, +7
आयनीकरण ऊर्जा: 1254.9 (13.01) केजे / एमओएल (ईवी)
इलेक्ट्रॉन एफ़िनिटी: 34 9 (केजे / एमओएल)
पॉलिंडा द्वारा बिजली: 3.20
एक साधारण पदार्थ की विशेषता
संचार प्रकार: वाचा गैर-ध्रुवीय
डबल अणु
आइसोटोप: 35 सीएल (75.78%) और 37 सीएल (24.22%)
क्रिस्टल जाली का प्रकार: आणविक
थर्मोडायनामिक पैरामीटर
तालिका 4।
भौतिक गुण
तालिका 5।
रासायनिक गुण
क्लोरीन का जलीय घोल काफी हद तक नष्ट हो गया है ("क्लोरीन पानी")
1 चरण: सीएल 2 + एच 2 ओ \u003d एचसीएल + एचओसीएल
2 चरण: HOCL \u003d HCL + [O] - परमाणु ऑक्सीजन
उपसमूह में ऑक्सीडेटिव क्षमता फ्लोराइड से आयोडीन \u003d ˃ तक घट जाती है
क्लोरीन मजबूत ऑक्सीडाइज़र:
1. सरल पदार्थों के साथ बातचीत
ए) हाइड्रोजन के साथ:
सीएल 2 + एच 2 \u003d 2 एचसीएल
बी) धातुओं के साथ:
सीएल 2 + 2 एन \u003d 2 एनएसीएल
3Cl 2 + 2FE \u003d 2FECL 3
ग) कुछ कम बिजली नकारात्मक गैर-धातुओं के साथ:
3Cl 2 + 2P \u003d 2PCL 3
सीएल 2 + एस \u003d एससीएल 2
ऑक्सीजन, कार्बन और नाइट्रोजन क्लोरीन के साथ सीधे प्रतिक्रिया नहीं करता!
2. जटिल पदार्थों के साथ बातचीत
a) पानी के साथ: ऊपर देखें
बी) एसिड के साथ: प्रतिक्रिया नहीं करता!
सी) क्षारों के समाधान के साथ:
ठंड पर: सीएल 2 +2 NAOH \u003d NACL + NACLO + H 2 o
गर्म होने पर: 3CL 2 + 6 KOH \u003d 5KCL + KCLO 3 + 3H 2 O
ई) कई कार्बनिक पदार्थों के साथ:
सीएल 2 + सीएच 4 \u003d सी 3 सीएल + एचसीएल
सी 6 एच 6 + सीएल 2 \u003d सी 6 एच 5 सीएल + एचसीएल
सबसे महत्वपूर्ण यौगिक क्लोरीन
 क्लोराइड हाइड्रोजन क्लोराइड(एचसीएल) - एक तेज गंध के साथ रंगहीन, थर्मलली स्थिर गैस (सामान्य परिस्थितियों में), गीली हवा में धूम्रपान, क्लोराइड (हाइड्रोक्लोरिक) एसिड के गठन के साथ आसानी से पानी (पानी की मात्रा 500 गैस वॉल्यूम तक) को आसानी से भंग कर दिया जाता है। -114.22 डिग्री सेल्सियस एचसीएल एक कठिन राज्य में जाता है। एक ठोस राज्य में, क्लोराइड दो क्रिस्टलीय संशोधनों के रूप में है: Rhombic, नीचे स्थिर और घन।
क्लोराइड हाइड्रोजन क्लोराइड(एचसीएल) - एक तेज गंध के साथ रंगहीन, थर्मलली स्थिर गैस (सामान्य परिस्थितियों में), गीली हवा में धूम्रपान, क्लोराइड (हाइड्रोक्लोरिक) एसिड के गठन के साथ आसानी से पानी (पानी की मात्रा 500 गैस वॉल्यूम तक) को आसानी से भंग कर दिया जाता है। -114.22 डिग्री सेल्सियस एचसीएल एक कठिन राज्य में जाता है। एक ठोस राज्य में, क्लोराइड दो क्रिस्टलीय संशोधनों के रूप में है: Rhombic, नीचे स्थिर और घन।
हाइड्रोजन क्लोराइड का एक जलीय घोल हाइड्रोक्लोरिक एसिड कहा जाता है। पानी में भंग होने पर, निम्नलिखित प्रक्रियाएं आगे बढ़ती हैं:
एचसीएल आर + एच 2 ओ डब्ल्यू \u003d एच 3 ओ + एफ + सीएल -
विघटन प्रक्रिया अत्यधिक exothermic है। पानी एचसीएल के साथ Azeotropic मिश्रण बनाता है। यह एक मजबूत मोनोसोकॉन्ड एसिड है। हाइड्रोजन के बाईं ओर खड़े सभी धातुओं के साथ ऊर्जावान रूप से बातचीत करता है, मूल और उभयचरिक ऑक्साइड, बेस और लवण, नमक बनाने के साथ - क्लोरिडा:
एमजी + 2 एचसीएल → एमजीसीएल 2 + एच 2
Feo + 2 एचसीएल → fecl 2 + एच 2 ओ
मजबूत ऑक्सीकरण एजेंटों की कार्रवाई के तहत या इलेक्ट्रोलिसिस के साथ, क्लोराइड गुणों को कम करने में प्रदर्शित करता है:
एमएनओ 2 + 4 एचसीएल → एमएनसीएल 2 + सीएल 2 + 2 एच 2 ओ
हीटिंग करते समय, क्लोराइड ऑक्सीजन के साथ ऑक्सीकरण होता है (उत्प्रेरक - कोक 2 क्लोराइड (ii) 2):
4 एचसीएल + ओ 2 → 2 एच 2 ओ +2 सीएल 2
हालांकि, केंद्रित हाइड्रोक्लोरिक एसिड तांबा के साथ प्रतिक्रिया करता है, मोनोवलेंट तांबा का परिसर बनता है:
2 सीयू + 4 एचसीएल → 2 एच + एच 2
केंद्रित हाइड्रोक्लोरिक के 3 वॉल्यूम पार्ट्स और केंद्रित नाइट्रिक एसिड के 1 वॉल्यूम अंश के मिश्रण को "ज़ारिस्ट वोदका" कहा जाता है। रॉयल वोदका भी सोने और प्लैटिनम को भंग करने में सक्षम है। रॉयल वोदका की उच्च ऑक्सीडेटिव गतिविधि नाइट्रोजन और क्लोरीन क्लोराइड की उपस्थिति के कारण है, जो स्रोत पदार्थों के साथ संतुलन में हैं:
4 एच 3 ओ + + 3 सीएल - + नहीं 3 - \u003d एनओसीएल + सीएल 2 + 6 एच 2 ओ
समाधान में क्लोराइड आयनों की उच्च सांद्रता के कारण, धातु क्लोराइड परिसर से जुड़ा हुआ है, जो इसके विघटन में योगदान देता है:
3 PT + 4 HNO 3 + 18 HCL → 3 H 2 + 4 NO + 8 H 2 o
क्लोराउडोर के लिए, कई संबंधों की प्रतिक्रिया (इलेक्ट्रोफाइल कनेक्शन) भी विशेषता है:
आर-सी \u003d सीएच 2 + एचसीएल → आर-सीएचसीएल-सी 3
आर-सींच + 2 एचसीएल → आर-सीसीएल 2-सीएच 3
क्लोरीन ऑक्साइड - क्लोरीन और ऑक्सीजन के अकार्बनिक रासायनिक यौगिक, सामान्य सूत्र: सीएल एक्स ओ।
क्लोरीन निम्नलिखित ऑक्साइड बनाती है: सीएल 2 ओ, सीएल 2 ओ 3, क्लो 2, सीएल 2 ओ 4, सीएल 2 ओ 6, सीएल 2 ओ 7। इसके अलावा, एक अल्पकालिक क्लो कट्टरपंथी, क्लोरीन क्लोरीन का एक कट्टरपंथी और एक कट्टरपंथी क्लोरीन टेट्राओक्साइड क्लॉ 4 कट्टरपंथी।
नीचे तालिका में स्थिर क्लोरीन ऑक्साइड के गुण दिखाता है:
तालिका 6।
| संपत्ति | सीएल 2 ओ। | क्लो 2। | क्लोक्लो 3। | सीएल 2 ओ 6 (जी) ↔2CLO 3 (जी) | सीएल 2 ओ 7 |
| बिस्तर के साथ रंग और स्थिति। तापमान | ग्रे-ब्राउन गैस | ग्रे-हरी गैस | हल्का पीला तरल | गहरा लाल तरल | रंगहीन तरल |
| ऑक्सीकरण क्लोरीन की डिग्री | (+1) | (+4) | (+1), (+7) | (+6) | (+7) |
| टी। पीएल, डिग्री सेल्सियस | −120,6 | −59 | −117 | 3,5 | −91,5 |
| टी। किप।, ° C | 2,0 | 44,5 | |||
| डी (एफ, 0 डिग्री सेल्सियस), जी * सेमी -3 | - | 1,64 | 1,806 | - | 2,02 |
| ΔH ° ORG (GAZ, 298 K), KJ * MOL -1 | 80,3 | 102,6 | ~180 | (155) | |
| ΔG डिग्री सीपीए (गज़, 2 9 8 के), केजे * एमओएल -1 | 97,9 | 120,6 | - | - | - |
| एस ° ऑर्गन (गज़, 2 9 8 के), जे * के -1 * मोल -1 | 265,9 | 256,7 | 327,2 | - | - |
| डीपोल पल μ, डी | 0.78 ± 0.08। | 1.78 ± 0.01 | - | - | 0.72 ± 0.02। |
 क्लोरीन ऑक्साइड (i), डिक्लोर का ऑक्साइड, क्लोरोथिक एसिड एनहाइड्राइड - क्लोरीन यौगिक ऑक्सीजन के साथ ऑक्सीकरण की डिग्री में।
क्लोरीन ऑक्साइड (i), डिक्लोर का ऑक्साइड, क्लोरोथिक एसिड एनहाइड्राइड - क्लोरीन यौगिक ऑक्सीजन के साथ ऑक्सीकरण की डिग्री में।
सामान्य परिस्थितियों में, यह एक भूरे रंग की पीले गैस है जिसमें क्लोरीन गंध जैसा दिखने वाली विशेषता गंध होती है। 2 डिग्री सेल्सियस से नीचे तापमान - गोल्डन-रेड तरल। जहरीला: श्वसन पथ पर हमला करता है। अनायास धीरे-धीरे विघटित:
बड़ी सांद्रता पर विस्फोटक हैं। सामान्य परिस्थितियों में घनत्व 3.22 किलो / m³। चार क्लोराइड कार्बन में घुल जाता है। कमजोर च्लोर्नोटिक एसिड के गठन के साथ पानी में अच्छी तरह से घुलनशील:
क्षार के साथ जल्दी से प्रतिक्रिया करता है:
सीएल 2 ओ + 2NAOH (आरएससी) \u003d 2naclo + एच 2 ओ
क्लोरिन डाइऑक्साइड - एसिड ऑक्साइड। पानी में भंग होने पर, क्लोराइड और क्लोरिनेटेड एसिड (असंगत प्रतिक्रिया प्रतिक्रिया) गठित होते हैं। पतला समाधान अंधेरे में प्रतिरोधी होते हैं, प्रकाश धीरे-धीरे विघटित होता है:
 क्लोरिन डाइऑक्साइड - क्लोरीन ऑक्साइड ( चतुर्थ), क्लोरीन और ऑक्सीजन यौगिक, सूत्र: क्लो 2।
क्लोरिन डाइऑक्साइड - क्लोरीन ऑक्साइड ( चतुर्थ), क्लोरीन और ऑक्सीजन यौगिक, सूत्र: क्लो 2।
सामान्य परिस्थितियों में, क्लॉ 2 एक विशेष गंध के साथ एक लाल-पीले गैस गैस है। 10 डिग्री सेल्सियस के नीचे तापमान पर एक लाल भूरा तरल है। मोटे प्रतिरोधी, ऑक्सीकरण एजेंटों और गर्म होने पर संपर्कों के दौरान प्रकाश के लिए विस्फोट। अच्छी तरह से पानी में घुलनशील। क्लोरीन डाइऑक्साइड की विस्फोट के कारण, तरल के रूप में स्टोर करना असंभव है।
एसिड ऑक्साइड। पानी में भंग होने पर, क्लोराइड और क्लोरिनेटेड एसिड (असंगत प्रतिक्रिया प्रतिक्रिया) गठित होते हैं। पतला समाधान अंधेरे में प्रतिरोधी होते हैं, प्रकाश धीरे-धीरे विघटित होता है:
परिणामी क्लोराइड एसिड बहुत अस्थिर और विघटित है:
रेडॉक्स गुण दिखाता है।
2CLO 2 + 5H 2 SO 4 (RSC) + 10FESO 4 \u003d 5FE 2 (इसलिए 4) 3 + 2HCL + 4H 2 O
क्लॉ 2 + 2NAOH गर्म। \u003d NACLO 2 + NACLO 3 + H 2 o
क्लो 2 + ओ 3 \u003d क्लो 3 + ओ 2
क्लॉ 2 कार्बनिक यौगिकों के साथ कई लोगों के साथ प्रतिक्रिया करता है और मध्यम बल के ऑक्सीकरण एजेंट को करता है।
 च्लोरनिक एसिड - एचसीएलओ, बहुत कमजोर मोनोसोकॉन्ड एसिड, जिसमें क्लोरीन में ऑक्सीकरण की डिग्री +1 है। केवल समाधान हैं।
च्लोरनिक एसिड - एचसीएलओ, बहुत कमजोर मोनोसोकॉन्ड एसिड, जिसमें क्लोरीन में ऑक्सीकरण की डिग्री +1 है। केवल समाधान हैं।
जलीय समाधान में, क्लोरोथिक एसिड आंशिक रूप से प्रोटॉन और हाइपोक्लोराइट-आयन क्लो पर विघटित होता है -:
अस्थिर। Chlornanotic एसिड और इसके नमक - हाइपोक्लोराइट्स - मजबूत ऑक्सीडाइज़र। एक आणविक क्लोरीन बनाने, एचसीएल हाइड्रोक्लोरिक एसिड के साथ प्रतिक्रिया करता है:
HCLO + NAOH (RSC) \u003d NACLO + H 2 o 
क्लोरीस एसिड - एचसीएलओ 2, मध्यम शक्ति का सिंगल-एक्सिस एसिड।
क्लोराइड एसिड एनसीएलओ 2 अस्थिर के मुक्त रूप में, यहां तक \u200b\u200bकि पतला जलीय घोल में भी, यह जल्दी से विघटित करता है:
क्षारीय द्वारा तटस्थ।
एचसीएलओ 2 + NAOH (आरएससी। गर्म।) \u003d Naclo 2 + एच 2 ओ
इस एसिड का एनहाइड्राइड अज्ञात है।
एसिड समाधान अपने लवण से प्राप्त किया जाता है - क्लोराइटएक पिच के साथ क्लो 2 की बातचीत के परिणामस्वरूप:
रेडॉक्स गुणों को साफ़ करता है।
5 एचसीएलओ 2 + 3 एच 2 सो 4 (आरएससी) + 2 किमी 5 \u003d 5 एचसीएलओ 3 + 2 एमएनएसओ 4 + के 2 तो 4 + 3 एच 2 ओ
 क्लोरिक एसिड - एचसीएलओ 3, मजबूत मोनोसॉकोन्ड एसिड, जिसमें क्लोरीन में ऑक्सीकरण की डिग्री +5 है। नि: शुल्क फॉर्म प्राप्त नहीं किया गया है; ठंड में 30% से नीचे एकाग्रता पर जलीय समाधान में काफी स्थिर है; अधिक केंद्रित समाधानों में, विघटित:
क्लोरिक एसिड - एचसीएलओ 3, मजबूत मोनोसॉकोन्ड एसिड, जिसमें क्लोरीन में ऑक्सीकरण की डिग्री +5 है। नि: शुल्क फॉर्म प्राप्त नहीं किया गया है; ठंड में 30% से नीचे एकाग्रता पर जलीय समाधान में काफी स्थिर है; अधिक केंद्रित समाधानों में, विघटित:
चोलोर्निक एसिड - एक मजबूत ऑक्सीडाइज़र; बढ़ती एकाग्रता और तापमान के साथ ऑक्सीडेटिव क्षमता बढ़ जाती है। एचसीएलओ 3 आसानी से हाइड्रोक्लोरिक एसिड को बहाल किया गया है:
एचसीएलओ 3 + 5 एचसीएल (कॉन्स।) \u003d 3 एल 2 + 3 एच 2 ओ
एचसीएलओ 3 + NaOH (Spz।) \u003d Naclo 3 + एच 2 ओ
जब 2 और हवा का मिश्रण दृढ़ता से अम्लीय समाधान के माध्यम से पारित किया जाता है, क्लोरीन डाइऑक्साइड का गठन होता है:
40% क्लोरिनिक एसिड आग में, उदाहरण के लिए, फ़िल्टर पेपर।
8. प्रकृति में खोजना:
पृथ्वी की परत में क्लोरीन सबसे आम हलोजन है। चूंकि क्लोरीन बहुत सक्रिय है, प्रकृति में यह केवल खनिजों में यौगिकों के रूप में पाया जाता है।
तालिका 7. प्रकृति में खोजना
तालिका 7. खनिज रूप
सबसे बड़ा क्लोरीन भंडार समुद्र और महासागरों के नमक की संरचना में निहित है।
प्राप्त
क्लोरीन के उत्पादन के लिए रासायनिक तरीके अप्रभावी और लागत हैं। आज तक, वे मुख्य रूप से ऐतिहासिक महत्व हैं। इसे हाइड्रोक्लोरिक एसिड के साथ पोटेशियम परमैंगनेट की बातचीत में प्राप्त किया जा सकता है:
शील विधि
प्रारंभ में, क्लोरीन प्राप्त करने के लिए औद्योगिक विधि शेली की विधि पर आधारित थी, यानी, हाइड्रोक्लोरिक एसिड के साथ पाइरो-हाइड्रोक्लोराइड प्रतिक्रिया:
विधि डिकॉन
क्लोरीडोर एयर ऑक्सीजन के उत्प्रेरक ऑक्सीकरण के साथ क्लोरीन बनाने के लिए विधि।
इलेक्ट्रोकेमिकल तरीके
आज, एक औद्योगिक पैमाने पर क्लोरीन सोडियम नमक के समाधान के इलेक्ट्रोलिसिस द्वारा सोडियम हाइड्रॉक्साइड और हाइड्रोजन के साथ प्राप्त किया जाता है, जिनमें से मुख्य प्रक्रियाएं कुल सूत्र द्वारा सबमिट की जा सकती हैं:
आवेदन
क्लोरीन युक्त पॉलिमर से बना विंडो प्रोफाइल
· ब्लीचिंग का मुख्य घटक लैबराकोवा पानी (सोडियम हाइपोक्लोराइट) है
पॉलीविनाइल क्लोराइड, प्लास्टिक, सिंथेटिक रबड़ के उत्पादन में।
· क्लोरोरोरगैनिक का उत्पादन। उत्पादित क्लोरीन का एक महत्वपूर्ण हिस्सा पौधे संरक्षण उपकरण पर खर्च किया जाता है। सबसे महत्वपूर्ण कीटनाशकों में से एक हैक्साक्लोरसाइक्लोहेक्सन (जिसे अक्सर हेक्साक्लोरोरन कहा जाता है)।
· एक लड़ाकू विषाक्तता पदार्थ के रूप में उपयोग किया जाता है, साथ ही साथ अन्य युद्ध विषाक्तता पदार्थों के उत्पादन के लिए: आईपीआरआईटी, फॉस्जीन।
पानी कीटाणुरहित करने के लिए - "क्लोरीनीकरण"।
खाद्य उद्योग आहार पूरक E925 के रूप में पंजीकृत है।
हाइड्रोक्लोरिक एसिड, क्लोरीन नींबू, बर्टोलन नमक, धातु क्लोराइड, जहर, दवाइयों, उर्वरकों के रासायनिक उत्पादन में।
शुद्ध धातुओं के उत्पादन के लिए धातु विज्ञान में: टाइटेनियम, टिन, टैंटलम, निओबियम।
· क्लोरीन-आर्गन डिटेक्टरों में सौर न्यूट्रिंस के संकेतक के रूप में।
कई विकसित देश क्लोरीन के उपयोग को रोजमर्रा की जिंदगी में सीमित करना चाहते हैं, जिसमें क्लोरीन युक्त कचरे के दहन के साथ, डाइऑक्साइन की एक महत्वपूर्ण मात्रा का गठन किया जाता है।
क्लोरीन को शायद अधिक एल्केमिस्ट प्राप्त हुए, लेकिन उनकी खोज और पहला अध्ययन प्रसिद्ध स्वीडिश रसायनज्ञ कार्ल विल्हेम शेली के नाम से अनजाने में जुड़ा हुआ था। शेली ने पांच रासायनिक तत्वों को खोला - बेरियम और मैंगनीज (युहान गण के साथ), मोलिब्डेनम, टंगस्टन, क्लोरीन, और अन्य रसायनज्ञों के बावजूद (हालांकि बाद में) - तीन और: ऑक्सीजन, हाइड्रोजन और नाइट्रोजन। यह उपलब्धि बाद में कोई केमिस्ट को दोहराने में असमर्थ थी। साथ ही, शेली, जो स्वीडिश रॉयल एकेडमी ऑफ साइंसेज के सदस्य द्वारा चुने गए थे, चेपिंग में एक साधारण फार्मासिस्ट थे, हालांकि वह अधिक सम्मानजनक और प्रतिष्ठित स्थिति ले सकते थे। फ्रेडरिक द्वितीय महान खुद, प्रशिया राजा ने उन्हें बर्लिन विश्वविद्यालय की रसायन शास्त्र के प्रोफेसर के पद को लेने की पेशकश की। इस तरह के मोहकों के प्रस्तावों से इनकार करते हुए, सिएल ने कहा: "मैं अपनी ज़रूरत से ज्यादा नहीं खा सकता, और मैं चेपिंग में यहां क्या कमा सकता हूं, मेरे पास भोजन के लिए पर्याप्त है।"
कई क्लोरीन यौगिकों को निश्चित रूप से, शेली से बहुत पहले जाना जाता था। यह तत्व सबसे प्रसिद्ध टेबल नमक सहित कई लवण का हिस्सा है। 1774 में, शेली ने क्लोरीन को मुफ्त रूप में हाइलाइट किया, केंद्रित हाइड्रोक्लोरिक एसिड के साथ काले खनिज पायरोल्यूजन को गर्म किया: एमएनओ 2 + 4 एचसीएल ® सीएल 2 + एमएनसीएल 2 + 2 एच 2 ओ।
प्रारंभ में, रसायनविदों ने क्लोरीन को एक तत्व के रूप में नहीं माना, बल्कि ऑक्सीजन के साथ मुरिया (लैटिन मुरिया - ब्राइन से) के अज्ञात तत्व के रासायनिक परिसर के रूप में। ऐसा माना जाता था कि हाइड्रोक्लोरिक एसिड माना जाता था (इसे भित्तिचित्र कहा जाता था) में रासायनिक रूप से बाध्य ऑक्सीजन होता है। यह "प्रमाणित", विशेष रूप से, ऐसा तथ्य: जब क्लोरीन का समाधान खड़ा होता है, तो ऑक्सीजन इसे जारी किया गया था, और हाइड्रोक्लोरिक एसिड समाधान में बने रहे। हालांकि, क्लोरीन से ऑक्सीजन "फाड़ने" के कई प्रयासों ने कुछ भी नहीं किया। इसलिए, कोई भी कार्बन डाइऑक्साइड प्राप्त करने में कामयाब रहा, कोयले के साथ क्लोरीन को गर्म करने में कामयाब रहा (जो उच्च तापमान पर "इसमें कई यौगिकों से ऑक्सीजन" निकाला जाता है)। जेमफ्री डेवी, जोसेफ लुइस समलैंगिक-लुउसक और लुई जैक्स टेनर द्वारा किए गए ऐसे प्रयोगों के परिणामस्वरूप, यह स्पष्ट हो गया कि क्लोरीन में ऑक्सीजन नहीं है और यह एक साधारण पदार्थ है। इसके अलावा, प्रयोगों ने समलैंगिक-लुससाक के प्रयोगों का नेतृत्व किया, जिसने हाइड्रोजन के साथ क्लोरीन प्रतिक्रिया में गैसों के मात्रात्मक अनुपात का विश्लेषण किया।
1811 में, डेवी ने यूनानी से एक नए तत्व के लिए "क्लोरिन" नाम का प्रस्ताव दिया। "क्लोरोस" पीला-हरा है। यह एक ऐसा रंग है जिसमें क्लोरीन है। वही रूट "क्लोरोफिल" शब्द में है (ग्रीक से। क्लोरोस "और" फिलॉन "- लीफ)। एक साल बाद, समलैंगिक लुसाक "कट" नाम क्लोरीन के लिए। लेकिन अब तक ब्रिटिश (और अमेरिकियों) को इस तत्व को "क्लोरीन" (क्लोरीन) कहा जाता है, जबकि फ्रांसीसी क्लोरीन (क्लोरीन) हैं। संक्षिप्त नाम और जर्मनों को स्वीकार करें - "लगभग केवल 19 वी में रसायन विज्ञान के" सांसद " (जर्मन क्लोरीन - क्लोर)। 1811 में, जर्मन भौतिक विज्ञानी जोहान श्वाईहेर ने क्लोरीन के लिए "हलोजन" नाम का सुझाव दिया (ग्रीक "हल" - नमक, और "जेननाओ" - जन्म देने)। इसके बाद, यह शब्द न केवल क्लोरीन के लिए, बल्कि सातवें समूह के अनुसार अपने सभी अनुरूपों के लिए भी है - फ्लोराइन, ब्रोमाइन, आयोडीन, सहायक।
क्लोरीन के वातावरण में हाइड्रोजन जलने का प्रदर्शन दिलचस्प है: कभी-कभी एक असामान्य साइड इफेक्ट अनुभव के दौरान होता है: एक बज़ सुना जाता है। अक्सर, ज्वाला गूंज रहा है जब पतली ट्यूब हाइड्रोजन द्वारा खिलाया जाता है, क्लोरो से भरे शंकु आकार के पोत में कम हो जाता है; गोलाकार फ्लास्क के लिए भी यही सच है, लेकिन सिलेंडरों में ज्वाला आमतौर पर buzzing नहीं है। इस घटना को "बुवाई ज्वाला" कहा जाता था।
एक जलीय घोल में, क्लोरीन आंशिक रूप से और धीरे-धीरे पानी के साथ प्रतिक्रिया करता है; 25 डिग्री सेल्सियस पर, संतुलन: सीएल 2 + एच 2 ओ एचसीएलओ + एचसीएल दो दिनों के लिए स्थापित है। प्रकाश विघटन में क्लोरिनस एसिड: एचसीएलओ ® एचसीएल + ओ। यह परमाणु ऑक्सीजन है जो व्हाइटनिंग प्रभाव को आकर्षित करता है (बिल्कुल सूखी क्लोरीन की ऐसी क्षमता नहीं होती है)।
क्लोरीन अपने यौगिकों में ऑक्सीकरण की सभी डिग्री प्रदर्शित कर सकता है - -1 से +7 तक। क्लोरीन ऑक्सीजन के साथ ऑक्साइड की एक श्रृंखला बनाती है, वे सभी शुद्ध रूप में हैं अस्थिर और विस्फोटक हैं: सीएल 2 ओ पीला-नारंगी गैस है, क्लो 2 - पीला गैस (9.7 डिग्री सेल्सियस से नीचे - उज्ज्वल रंग तरल), क्लोराइन क्लोरीन सीएल 2 ओ 4 (क्लो -क्लो 3, लाइट पीला तरल), सीएल 2 ओ 6 (ओ 2 सीएल-ओ-क्लो 3, उज्ज्वल लाल तरल), सीएल 2 ओ 7 - रंगहीन बहुत विस्फोटक तरल। कम तापमान पर, अस्थिर सीएल 2 ओ 3 और क्लॉ 3 ऑक्साइड प्राप्त किए गए थे। क्लॉ 2 ऑक्साइड एक औद्योगिक पैमाने पर उत्पादित किया जाता है और पीने के पानी और सीवेज की कीटाणुशोधन के लिए क्लोरीन के बजाय क्लोरीन के बजाय उपयोग किया जाता है। अन्य हलोजन के साथ, क्लोरीन कई तथाकथित इंटरजेजोजेनिक यौगिकों का निर्माण करता है, उदाहरण के लिए, सीएलएफ, सीएलएफ 3, सीएलएफ 5, बीआरसीएल, आईसीएल, आईसीएल 3।
ऑक्सीकरण की सकारात्मक डिग्री वाले क्लोरीन और इसके यौगिक मजबूत ऑक्सीडाइज़र हैं। 1822 में, जर्मन केमिस्ट लियोपोल्ड जीमेलिन पीले रक्त नमक से क्लोरीन को ऑक्सीकरण करके: 2 के 4 + सीएल 2 ® के 3 + 2 केसीएल। क्लोरीन ब्रोमेन और आयोडीन के एक मुक्त रूप के साथ ब्रोमाइड और क्लोराइड को आसानी से ऑक्सीकरण करता है।
विभिन्न ऑक्सीकरण डिग्री में क्लोरीन एसिड की एक पंक्ति बनाती है: एचसीएल - क्लोराइड (नमक, लवण - क्लोराइड), एचसीएलओ - क्लोरिनस (लवण - हाइपोक्लोराइट्स), एचसीएलओ 2 - क्लोराइड (लवण - क्लोराइट), एचसीएलओ 3 - क्लोरोनेंट (लवण - क्लोरेट्स) , एचसीएलओ 4 - क्लोरीन (लवण - परक्लोराइट्स)। ऑक्सीजन एसिड के अपने शुद्ध रूप में, केवल क्लोरीन स्थिर है। ऑक्सीजन एसिड के लवण से। व्यावहारिक अनुप्रयोगों में हाइपोक्लोराइट्स, सोडियम क्लोराइट एनएसीएलओ 2 - ऑक्सीजन ("ऑक्सीजन मोमबत्तियों") के कॉम्पैक्ट पायरोटेक्निक स्रोतों के निर्माण के लिए, पोटेशियम क्लोरेट (बर्टोलेट नमक), कैल्शियम और मैग्नीशियम (कृषि का मुकाबला करने के लिए) कीट, पायरोटेक्निक रचनाओं और विस्फोटकों के घटकों के रूप में, मैचों के उत्पादन में), पर्क्लोरेट्स - विस्फोटक और पायरोटेक्निक रचनाओं के घटक; अमोनियम परक्लोराइट ठोस रॉकेट ईंधन का एक घटक है।
क्लोरीन कई कार्बनिक यौगिकों के साथ प्रतिक्रिया करता है। यह जल्दी से डबल और ट्रिपल कार्बन कार्बन बॉन्ड के साथ असंतृप्त यौगिकों में शामिल हो जाता है (एसिटिलीन के साथ प्रतिक्रिया एक विस्फोट के साथ जाती है), और प्रकाश में - और बेंजीन में। कुछ स्थितियों के तहत, क्लोरीन कार्बनिक यौगिकों में हाइड्रोजन परमाणुओं को प्रतिस्थापित कर सकता है: आर-एच + सीएल 2 ® आरसीएल + एचसीएल। इस प्रतिक्रिया ने जैविक रसायन शास्त्र के इतिहास में एक महत्वपूर्ण भूमिका निभाई। 1840 के दशक में, फ्रांसीसी केमिस्ट जीन बैटिस्ट डूमा ने पाया कि अद्भुत आसानी से एसिटिक एसिड पर क्लोरीन की कार्रवाई के तहत एक प्रतिक्रिया है
सी 3 सोम + सीएल 2 ® सीएच 2 क्लॉकोह + एचसीएल। क्लोरीन की अधिकता के साथ, ट्राइक्लोरोएसेटिक एसिड एसएल 3 कॉक्सी बनती है। हालांकि, कई केमिस्ट ने अविश्वसनीय रूप से डूमा में प्रतिक्रिया व्यक्त की। दरअसल, आम तौर पर स्वीकार किए जाते हैं, बर्कलियस का सिद्धांत, सकारात्मक चार्ज हाइड्रोजन परमाणुओं को नकारात्मक चार्ज क्लोरीन परमाणुओं द्वारा प्रतिस्थापित नहीं किया जा सका। इस राय का पालन उस समय कई उत्कृष्ट रसायनविदों का पालन किया गया था, जिनमें से फ्रेडरिक वोलर, यस्टस लिबिह और निश्चित रूप से, बर्केलियस स्वयं थे।
डुमास का मजाक बनाने के लिए, वाइलर ने अपने मित्र लिबहा को एक नए सफल आवेदन के बारे में कुछ श्विनर (श्विनरर - जर्मन धोखाधड़ी में) की ओर से एक लेख दिया। लेख में, एक स्पष्ट फंसे हुए के साथ वाइलर ने एसिटिक एसिड मैंगनीज एमएन (सीएच 3 सीओओ) 2 में अपने वैलेंस के अनुसार, सभी तत्वों को प्रबंधित करने के बारे में लिखा, इसे क्लोरीन के साथ प्रतिस्थापित किया, जिसके परिणामस्वरूप पीले क्रिस्टलीय पदार्थ अकेले क्लोरीन शामिल हो। ऐसा कहा गया था कि इंग्लैंड में, कार्बनिक यौगिकों में कार्बनिक यौगिकों में क्लोरीन परमाणुओं पर सभी परमाणु, पारंपरिक ऊतक क्लोरीन में बदल जाते हैं, और यह कि चीजें अपनी उपस्थिति बरकरार रखती हैं। फुटनोट यह कहा गया था कि लंदन कोट की दुकानों को एक क्लोरीन से मिलकर एक सामग्री द्वारा कारोबार किया जाता है, क्योंकि यह सामग्री रात के कैप्स और गर्म विशेषताओं के लिए बहुत अच्छी है।
कार्बनिक यौगिकों के साथ क्लोरीन प्रतिक्रिया क्लोरोरोगनिक उत्पादों के एक सेट के गठन की ओर ले जाती है, जिनमें से मेथिलिन क्लोराइड सीएच 2 सीएल 2, क्लोरोफॉर्म सीएलसीएल 3, सीसीएल चार क्लोराइड क्लोराइड, ट्राइक्लोरिथीन सीएल \u003d सीसीएल 2, टेट्रैक्लथिलिन सी 2 सीएल के व्यापक रूप से उपयोग किए जाने वाले सॉल्वैंट्स का व्यापक रूप से उपयोग किया जाता है 4। नमी की उपस्थिति में, क्लोरीन पौधों की हरी पत्तियों को उड़ा देता है, कई रंग। यह अभी तक XVIII शताब्दी में इस्तेमाल किया गया था। Whitening कपड़े के लिए।
क्लोरीन जहर गैस के रूप में।
क्लोरीन शेलना ने अपनी बहुत ही अप्रिय तेज गंध, सांस लेने में कठिनाई और खांसी मनाई। बाद में, व्यक्ति को क्लोरीन की गंध महसूस होती है, भले ही एक लीटर हवा में इस गैस के केवल 0.005 मिलीग्राम हो, और साथ ही यह श्वसन पथ पर एक परेशान प्रभाव पड़ता है, श्वसन की श्लेष्म झिल्ली की कोशिकाओं को नष्ट कर देता है ट्रैक्ट और फेफड़े। 0.012 मिलीग्राम / एल की एकाग्रता कठिनाई के साथ पहना जाता है; यदि क्लोरीन की एकाग्रता 0.1 मिलीग्राम / एल से अधिक है, तो यह जीवन-धमकी दे रही है: श्वास महंगा है, यह आवेगपूर्ण हो जाता है, और फिर सबकुछ दुर्लभ होता है, और 5-25 मिनट के बाद, श्वास होता है। औद्योगिक उद्यमों की हवा में अधिकतम अनुमत 0.001 मिलीग्राम / एल की एकाग्रता है, और आवासीय क्षेत्रों की हवा में - 0.00003 मिलीग्राम / एल।
पीटर्सबर्ग अकादमिक टोवी Egorovich Lovitz, 17 9 0 में रेलेल के अनुभव को दोहराया, गलती से हवा में क्लोरीन की एक महत्वपूर्ण मात्रा जारी की। इसे छोड़कर, उसने चेतना खो दी और गिर गया, फिर आठ दिनों के लिए उसकी छाती में दर्दनाक दर्द से पीड़ित था। सौभाग्य से, वह बरामद हुआ। मैं लगभग मर गया, क्लोरीन पहुंचे, और प्रसिद्ध अंग्रेजी केमिस्ट डेवी। क्लोरीन की एक छोटी राशि के साथ भी प्रयोग खतरनाक हैं, क्योंकि वे गंभीर फेफड़ों की क्षति का कारण बन सकते हैं। ऐसा कहा जाता है कि जर्मन केमिस्ट ईगा Vieberg क्लोरीन पर उनके व्याख्यानों में से एक शब्द में शुरू हुआ: "क्लोरीन एक जहरीला गैस है। अगर मैं अगले प्रदर्शन के दौरान बाहर निकलता हूं, तो मुझे दूर ले जाओ, कृपया ताजा हवा पर। लेकिन एक ही समय में व्याख्यान को बाधित करना होगा। " अगर हम हवा में बहुत सारे क्लोरीन को छोड़ देते हैं, तो यह एक वास्तविक आपदा बन जाती है। इसने द्वितीय विश्व युद्ध के दौरान एंग्लो-फ्रेंच सैनिकों का अनुभव किया। 22 अप्रैल, 1 9 15 की सुबह, जर्मन कमांड ने युद्धों के इतिहास में पहला गैस हमला करने का फैसला किया: जब हवा के सामने के छोटे छह-किलोमीटर खंड पर, दुश्मन के किनारे हवा में उड़ा दिया आईपीआरएस के बेल्जियम शहर, 5730 सिलेंडर वाल्व एक ही समय में खोले गए, जिनमें से प्रत्येक में 30 किलोग्राम तरल क्लोरीन था। 5 मिनट के भीतर, एक विशाल पीला-हरा बादल का गठन किया गया, जो धीरे-धीरे मित्र राष्ट्रों की तरफ जर्मन खाई छोड़कर छोड़ दिया। ब्रिटिश और फ्रांसीसी सैनिक पूरी तरह से रक्षाहीन हो गए। गैस ने सभी आश्रयों में दरारों में प्रवेश किया, उससे कोई उद्धार नहीं हुआ: क्योंकि गैस मास्क का अभी तक आविष्कार नहीं किया गया है। नतीजतन, 15 हजार लोग जहर थे, जिनमें से 5 हजार - मौत के लिए। एक महीने में, 31 मई को, जर्मनों ने रूसी सैनिकों के खिलाफ पूर्वी मोर्चे पर गैस हमले को दोहराया। यह बोलिमोव शहर में पोलैंड में हुआ। 12 हज़ार सिलेंडरों के 12 किमी के सामने, 264 टन क्लोरीन मिश्रण काफी अधिक जहरीले फॉस्जीन (कोयला-एसिड क्लोराइड कोक्ट 2) जारी किए गए थे। रॉयल कमांड जानता था कि आईपीआर के दौरान क्या हुआ, और फिर भी, रूसी सैनिकों के पास सुरक्षा का कोई साधन नहीं था! गैस हमले के परिणामस्वरूप, हानि 9146 लोगों की राशि थी, जिनमें से केवल 108 राइफल और तोपखाने के गोले के परिणामस्वरूप थे, शेष जहर थे। उसी समय, 1183 लोगों की मृत्यु लगभग तुरंत हुई।
जल्द ही रसायनविदों ने संकेत दिया कि क्लोरीन से कैसे बचें: सोडियम थियोसल्फेट समाधान के साथ लगाए गए एक गौज पट्टी के माध्यम से सांस लेना आवश्यक है (इस पदार्थ का उपयोग फोटो में किया जाता है, इसे अक्सर हाइपोसुलफाइट कहा जाता है)। क्लोरीन बहुत जल्दी थियोसल्फेट के समाधान के साथ प्रतिक्रिया करता है, इसे ऑक्सीकरण करता है:
एनए 2 एस 2 ओ 3 + 4 एल 2 + 5 एच 2 ओ ® 2 एच 2 तो 4 + 2 एनएसीएल + 6 एचसीएल। बेशक, सल्फ्यूरिक एसिड भी एक हानिकारक पदार्थ नहीं है, लेकिन इसका पतला जलीय घोल जहरीले क्लोरीन की तुलना में बहुत कम खतरनाक है। इसलिए, उन वर्षों में थियोसल्फेट एक और नाम - "एंटीक्लर" दिखाई दिया, लेकिन पहला थियोसल्फेट गैस मास्क थोड़ा प्रभावी थे।
1 9 16 में, रूसी केमिस्ट, भविष्य के अकादमिक निकोलाई दिमित्रीक ज़ेलिंस्की ने वास्तव में प्रभावी गैस मास्क का आविष्कार किया, जिसमें सक्रिय कोयले की एक परत द्वारा जहरीले पदार्थों को हिरासत में लिया गया था। एक बहुत ही विकसित सतह के साथ इस तरह के कोयले hyposulphite के साथ गौज की तुलना में अधिक क्लोरीन देरी कर सकते हैं। सौभाग्य से, "क्लोरीन हमले" इतिहास में केवल एक दुखद एपिसोड बने रहे। विश्व युद्ध के बाद, क्लोरीन के पास केवल शांतिपूर्ण व्यवसाय थे।
क्लोरीन का उपयोग।
हर साल, क्लोरीन की बड़ी मात्रा होती है - लाखों टन के दसियों। केवल 20 वीं शताब्दी के अंत तक संयुक्त राज्य अमेरिका में। हर साल, लगभग 12 मिलियन टन क्लोरीन इलेक्ट्रोलिसिस द्वारा प्राप्त किए गए थे (रासायनिक उद्योगों के बीच 10 वां स्थान)। इसका मुख्य द्रव्यमान (50% तक) कार्बनिक यौगिकों के क्लोरिनेशन पर खर्च किया जाता है - सॉल्वैंट्स, सिंथेटिक रबड़, पॉलीविनाइल क्लोराइड और अन्य प्लास्टिक, क्लोरोपेरिन रबड़, कीटनाशकों, दवाओं, कई अन्य आवश्यक और उपयोगी उत्पादों को प्राप्त करने के लिए। बाकी जल शोधन के लिए लकड़ी लुगदी को सफ़ेद करने के लिए लुगदी और पेपर उद्योग में अकार्बनिक क्लोराइड के संश्लेषण के लिए खपत किया जाता है। अपेक्षाकृत कम मात्रा में, क्लोरीन का उपयोग धातु उद्योग में किया जाता है। इसके साथ, बहुत साफ धातुएं प्राप्त की जाती हैं - टाइटेनियम, टिन, टैंटलम, निओबियम। क्लोरीन में हाइड्रोजन की जलन क्लोराइड द्वारा प्राप्त की जाती है, और हाइड्रोक्लोरिक एसिड से प्राप्त होता है। क्लोरीन का उपयोग ब्लीचिंग पदार्थों (हाइपोक्लोराइट्स, क्लोरीन नींबू) और क्लोरीनीकरण के साथ पानी कीटाणुशोधन के उत्पादन के लिए भी किया जाता है।
इल्या लीन्सन
प्राप्त करने का मुख्य औद्योगिक तरीका एक केंद्रित NaCl (चित्र 96) है। साथ ही, इसे जारी किया गया है (2 एसएल '- 2 ई- \u003d सीएल 2), और कैथोड स्पेस (2 एन + 2 ई - \u003d एच 2) में जारी किया गया है और NaOH बनाता है।
प्रयोगशाला प्राप्त करने के साथ आमतौर पर एमएनओ 2 या केएमएनओ 4 की कार्रवाई का उपयोग करते हैं:
एमएनओ 2 + 4 एनएसएल \u003d एमएनएसएल 2 + सीएल 2 + 2 एन 2
2kmno 4 + 16nsl \u003d 2xl + 2mnsl 2 + 5сl 2 + 8h 2 o
इसके विशिष्ट रासायनिक समारोह से, यह एक सक्रिय monovalent metalloid भी है। हालांकि, यह उससे कम है। इसलिए, उत्तरार्द्ध यौगिकों से बाहर निकलने में सक्षम है।
सॉफ्टवेयर एच 2 + सीएल 2 \u003d 2 एचसीएल + 44 kcal के साथ बातचीत
सामान्य परिस्थितियों में, यह बेहद धीरे-धीरे होता है, लेकिन जब मिश्रण गर्म होता है या इसकी मजबूत रोशनी (सीधी धूप, जलन, आदि) के साथ होती है।
NaCl + H 2 SO 4 \u003d NAHSO 4 + HCL
NACL + NAHSO 4 \u003d NA 2 SO 4 + HCL
उनमें से पहला आंशिक रूप से सामान्य परिस्थितियों में आगे बढ़ता है और व्यावहारिक रूप से कम हीटिंग के उद्देश्य से होता है; दूसरा केवल उच्च स्तर पर किया जाता है। प्रक्रिया के लिए, एक यांत्रिक महान प्रदर्शन की सेवा।
सीएल 2 + एच 2 ओ \u003d एचसीएल + नोस्ल
एक अस्थिर कनेक्शन होने के नाते, नाक धीरे-धीरे इस तरह के पतले में भी विघटित होती है। जिसे क्लोरोथिक एसिड कहा जाता है, या। नाक खुद और यह बहुत मजबूत है।
इसे प्राप्त करने के लिए प्रतिक्रिया मिश्रण में जोड़ने का सबसे आसान तरीका है। चूंकि, जैसा कि पाया जाता है, यह दाईं ओर से जुड़ा होगा। उदाहरण के लिए, NaOH का उपयोग:
सीएल 2 + एच 2 ओ<–––> NOSL + HCL।
HOCL + NSL + 2NAOH ---\u003e NAOCL + NACL + 2H 2 O
या सामान्य रूप से:
सीएल 2 + 2NAOH ---\u003e Naocl + NaCl + N 2
इसके साथ बातचीत के परिणामस्वरूप, यह निकलता है, इसलिए, क्लोरोथी का मिश्रण और। बनाने (") में मजबूत ऑक्सीडेटिव गुण होते हैं और इसका व्यापक रूप से ब्लीचिंग के लिए उपयोग किया जाता है और।
1) नाक \u003d nsl + o
2) 2'एसएल \u003d एच 2 ओ + एसएल 2
3) 3HOCL \u003d 2NCL + NSLO 3
ये सभी प्रक्रियाएं एक साथ आगे बढ़ने में सक्षम हैं, लेकिन उनकी रिश्तेदार गति मौजूदा स्थितियों पर काफी निर्भर हैं। उत्तरार्द्ध को बदलकर, यह सुनिश्चित करना संभव है कि परिवर्तन लगभग एक दिशा में लगभग लक्षित होगा।
सीधे सूर्य के प्रकाश अपघटन की कार्रवाई के तहत उनमें से पहले पर जाता है। यह आसानी से संलग्न करने की उपस्थिति में भी बहती है, और कुछ (उदाहरण के लिए, ")।
तीसरे प्रकार में नाक का विघटन विशेष रूप से आसान होता है। इसलिए, गर्म पर कार्रवाई कुल समीकरण द्वारा व्यक्त की जाती है:
ZSL 2 + 6CON \u003d KCLO 3 + 5XL + 3N 2 O
2xlo 3 + एच 2 सी 2 ओ 4 \u003d के 2 सीओ 3 + सीओ 2 + एच 2 ओ + 2CLO 2
एक हरे-पीले डाइऑक्साइड का गठन होता है (पीएल। - 59 डिग्री सेल्सियस, टी। किप। + 10 डिग्री सेल्सियस)। मुफ्त क्लॉ 2 कम प्रतिरोधी और इसके साथ विघटन करने में सक्षम है