জল অণু বৈশিষ্ট্য। জল সূত্র H2O এর সমবায় বন্ডের সূত্র
সংজ্ঞা
জল (হাইড্রোজেন অক্সাইড) - বাইনারি অজৈব সংযোগ।
রাসায়নিক সূত্র: এইচ 2 ও।
কাঠামোগত সূত্র:
মোল্লার ওজন: 18,015২8 গ্রাম / মোল।
বিকল্প নাম: অক্সাইড, হাইড্রক্সাইড হাইড্রোজেন, হাইড্রক্সাইল এসিড, ডাইডাইড্রোজেন মনোক্সাইড, অক্সিডান, ডাইডাইড্রোমোনক্সাইড।
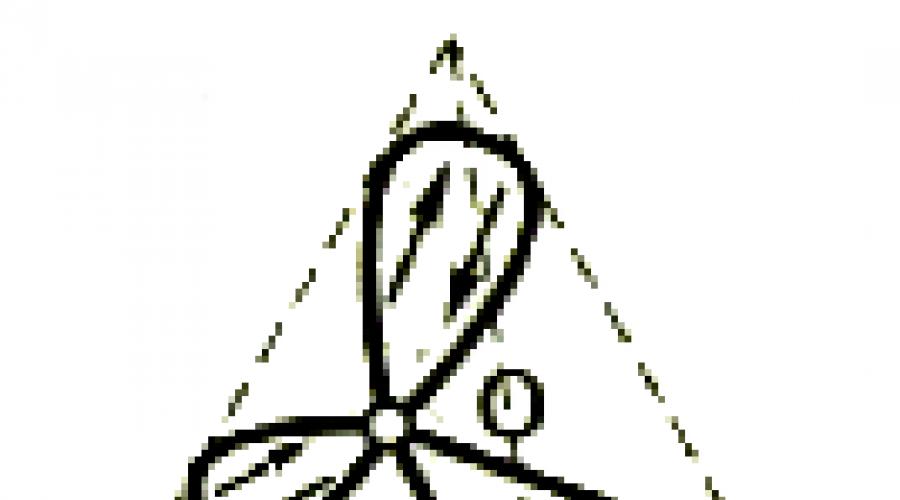
জল অণুতে, একটি অক্সিজেন পরমাণু এসপি 3-হাইব্রিডাইজেশন অবস্থায় থাকে, কারণ হাইব্রিড ওরাইটালগুলির গঠনে কেবলমাত্র ভ্যালেন্স ইলেকট্রনগুলি জড়িত নয়, তবে দুর্বল ইলেকট্রনিক জোড়া। হাইব্রিড Orbitals Tetrahedron শীর্ষে নির্দেশ করা হয়:

অণুতে অক্সিজেন এবং হাইড্রোজেন এর ইলেক্ট্রো-নেতিবাচকতার মধ্যে বড় পার্থক্যের কারণে, অণুটি দৃঢ়ভাবে ধ্রুবক হয় এবং ইলেক্ট্রন স্থানচ্যুতিটি পাশে থাকে। জল অণুর একটি বড় ডিপোল মুহূর্ত আছে, কারণ পোলার বন্ডগুলি অসম্মানিকভাবে অবস্থিত।
যোগাযোগের একটি শক্তিশালী মেরুকরণের সাথে হে - এইচ সম্পর্কিত শিক্ষা হাইড্রোজেন বন্ধন জল অণু মধ্যে। প্রতিটি পানির অণুটি চারটি হাইড্রোজেন বন্ড পর্যন্ত গঠন করতে পারে - তাদের মধ্যে দুটি অক্সিজেন পরমাণু এবং আরও দুটি হাইড্রোজেন পরমাণু গঠন করে:

হাইড্রোজেন বন্ড গঠনের ফলে এনালগ (সেলেনিয়াম এবং টেলুরিয়াম) এর হাইডাইডগুলির তুলনায় উচ্চতর উষ্ণ বিন্দু, সান্দ্রতা এবং পৃষ্ঠের টান টানটি নির্ধারণ করে।
আইসোটোপিক জল পরিবর্তন
হাইড্রোজেন আইসোটোপের ধরন উপর নির্ভর করে অণুতে অন্তর্ভুক্ত, নিম্নলিখিত আইসোটোপিক জল পরিবর্তন:
অক্সিজেনের তিনটি স্থিতিশীল আইসোটপ (16 ও, 17 ও 18 ও 18), 18 সূত্রের অণুগুলির 18 সূত্রটি আইসোটোপিক রচনাটিতে বিভক্ত করে। একটি নিয়ম হিসাবে, প্রাকৃতিক জল অণু এই সব জাতের রয়েছে।
"জল সূত্র" বিষয়গুলিতে সমস্যা সমাধানের উদাহরণ
উদাহরণ 1।
| কাজটি | 9 লিটার পানি জল রেডিয়েটারে বন্যা এবং 0.8 গ্রাম / এমএল এর ঘনত্বের সাথে ২ লিটার মিথাইল যোগ করা হয়েছে। ন্যূনতম তাপমাত্রায়, আপনি এখন গাড়িটিকে বাইরে চলে যেতে পারেন, ভয় ছাড়াই রেডিয়েটারের পানি স্থির থাকবে (ক্রিওস্কোপিক ওয়াটার কনস্ট্যান্টটি কি কেজি / মোলিতে 1.86)? |
| সিদ্ধান্ত | রাউল আইনের মতে, অ-ইলেক্ট্রোলাইটের পাতলা সমাধানগুলির ক্রিস্টালাইজেশনের তাপমাত্রায় হ্রাস করা হয়: কোথায়: - সমাধানের জমা তাপমাত্রা হ্রাস করা; Cr - Cryoscopic ধ্রুবক দ্রাবক; সি এম - সমাধান molaous ঘনত্ব; এম বি - দ্রাবক পদার্থ ভর; এম একটি - ভর দ্রাবক; এম বি দ্রবীভূত পদার্থের দোলার ভর। মিথাইল অ্যালকোহলের ভর সমান: পানি ভর সমান: মিথাইল অ্যালকোহল এর মোল্লার ভর 32G / MO এর সমান জমাটবদ্ধ তাপমাত্রায় পরিবর্তন গণনা করুন: |
| উত্তর | গাড়ী -10.3 ডিগ্রি সেলসিয়াসে তাপমাত্রায় রাস্তায় বামে যেতে পারে |
উদাহরণ 2।
| কাজটি | ২50 গ্রামে ২২ গ্রামে কতটি গ্রাম দ্রবীভূত করা উচিত 5% এনহাইড্রাসে একটি সমাধান পাওয়ার জন্য? |
| সিদ্ধান্ত | না 2 তাই 4 মোল্লার ভর হল: স্ফটিক হাইড্রেট এর দোলার ভর: এক্স হিসাবে দ্রবীভূত লবণের পরিমাণ (তামাশা) নির্দেশ করুন। তারপর সমাধান সমান হবে: সমাপ্ত সমাধানের মধ্যে নির্বাসক লবণের ভর সমান হবে: |
জল (হাইড্রোজেন অক্সাইড) একটি রাসায়নিক সূত্রের সাথে একটি বাইনারি অজৈব যৌগটি একটি রাসায়নিক সূত্রের সাথে 2 o. জল অণুর দুটি হাইড্রোজেন পরমাণু এবং এক-অক্সিজেন, যা একটি সমবায় বন্ড দ্বারা আন্তঃসংযোগ করা হয়।
হাইড্রোজেন পারঅক্সাইড.
প্রাকৃতিক ও রাসায়নিক বৈশিষ্ট্য
জলের শারীরিক ও রাসায়নিক বৈশিষ্ট্যগুলি অণুগুলির রাসায়নিক, ইলেকট্রনিক এবং স্থানীয় কাঠামোর দ্বারা নির্ধারিত হয়।
এইচ 2 0 অণুতে N এবং O পরমাণু তাদের স্থিতিশীল অক্সিডেশন ডিগ্রী, যথাক্রমে +1 এবং -2 হয়; অতএব, জল উচ্চারিত অক্সিডেটিভ বা বৈশিষ্ট্য হ্রাস না দেখায় না। অনুগ্রহ করে মনে রাখবেন: ধাতু হাইড্রোজেন এর হাইড্রাইডস অক্সিডেশন ডিগ্রী -1 হয়।

এইচ 2 ও অণু একটি কৌণিক গঠন আছে। এন-ও লিঙ্ক খুব মেরু হয়। পরমাণুতে একটি অতিরিক্ত নেতিবাচক চার্জ আছে, পরমাণু এন - অত্যধিক ইতিবাচক চার্জ। 8 পুরো এইচ 2 ও অণু পোলার, ই। dipolem। এটি ব্যাখ্যা করে যে পানি আইওনিক এবং মেরু পদার্থের জন্য একটি ভাল দ্রাবক।

পরমাণু এইচ এবং হে, সেইসাথে ধাপের ইলেকট্রনিক জোড়াগুলির উপর অপ্রয়োজনীয় চার্জগুলির উপস্থিতি হাইড্রোজেন বন্ডযুক্ত পানির অণুগুলির মধ্যে গঠন করে, যার ফলে তারা সহযোগীদের মধ্যে মিলিত হয়। এই সহযোগীদের অস্তিত্ব এম এর অস্বাভাবিক উচ্চ মান ব্যাখ্যা করে। ইত্যাদি জল।
হাইড্রোজেন বন্ড গঠনের পাশাপাশি এইচ 2 হে অণুগুলির পারস্পরিক প্রভাবের ফলাফল একে অপরকে তাদের স্ব-মনিং হয়:
এক অণুতে, মেরু যোগাযোগের হেটেটোলিক্যাল বিরতি ও-এইচ, এবং মুক্তিপ্রাপ্ত প্রোটন অন্য অণুগুলির অক্সিজেন পরমাণুতে যোগ দেয়। হাইড্রক্সোনিয়াম হাইড্রক্সোনিয়াম তৈরি করা আয়নটি মূলত হাইড্রোজেন আইওন এইচ + এইচ 2 ও, তাই এটি সরল জল স্ব-মোমিয়াম সমীকরণের দ্বারা সরলীকৃত হয় যেমন:
এইচ 2 ও ↔ এইচ + + ওহ -
জল dissociation ধ্রুবক অত্যন্ত ছোট:
এটি প্রস্তাব করে যে পানি আয়নগুলিতে খুব সামান্য অসঙ্গতি দেয়, এবং অতএব অ-শোষিত অণুগুলির ঘনত্ব ২ o প্রায় ধ্রুবক হয়:

পরিষ্কার জল [এইচ +] \u003d [আইটি -] \u003d 10 -7 mol / l। এর মানে হল যে পানি একটি খুব দুর্বল অ্যাম্ফোটিক ইলেক্ট্রোলাইট, যা একটি উল্লেখযোগ্য ডিগ্রী, না অম্লীয় বা মৌলিক বৈশিষ্ট্যগুলিতে উপস্থিত হয় না।
যাইহোক, জল ইলেক্ট্রোলাইটে একটি শক্তিশালী ionizing প্রভাব আছে এটি মধ্যে দ্রবীভূত। পানির ডিপোলসের কর্মকাণ্ডের অধীনে, সলিউটের অণুগুলির অণুতে মেরু সমবায় বন্ডগুলি আইওনিক রূপান্তরিত হয়, আয়নগুলি হাইড্রেটেড, তাদের মধ্যে লিঙ্কগুলি দুর্বল হয়ে পড়েছে, যার ফলে ইলেক্ট্রোলাইটিক বিচ্ছিন্নতা রয়েছে। উদাহরণ স্বরূপ:
HCL + H 2 O - H 3 O + + SL -
(শক্তিশালী ইলেক্ট্রোলাইট)
(বা হাইড্রেশন বাদে: HCL → H + + SL -)
CH 3 Coooh + H 2 o ↔ CH 3 Coo - + H + (দুর্বল ইলেক্ট্রোলাইট)
(অথবা ch 3 কোহ ↔ CH 3 COO - + H +)
এই প্রসেসগুলিতে ব্রনসেন্ড-লোআরির অ্যাসিড এবং বুনিয়াদের তত্ত্ব অনুযায়ী, পানিটি বেসের বৈশিষ্ট্যগুলি দেখায় (প্রোটন গ্রহণকারী)। একটি অ্যাসিড (প্রোটন দাতা) হিসাবে একই তত্ত্বের জন্য, জল প্রতিক্রিয়াগুলিতে কাজ করে, উদাহরণস্বরূপ, অ্যামোনিয়া এবং আমিনের সাথে:
এনএইচ 3 + এইচ 2 ও ↔ এনএইচ 4++ + ওহ -
CH 3 NH 2 + H 2 O ↔ CH 3 NH 3 + + ওহ -
জল অংশগ্রহণ সঙ্গে redox প্রতিক্রিয়া
I. প্রতিক্রিয়া যা জল অক্সিডাইজিং এজেন্টের ভূমিকা পালন করে
এই প্রতিক্রিয়াগুলি শুধুমাত্র শক্তিশালী হ্রাসকারী এজেন্টগুলির সাথে সম্ভব, যা হাইড্রোজেন আয়নগুলি পুনরুদ্ধার করতে সক্ষম হাইড্রোজেনকে মুক্ত করতে সক্ষম হাইড্রোজেন আয়নগুলি পুনরুদ্ধার করতে সক্ষম।
1) ধাতু সঙ্গে মিথস্ক্রিয়া
একটি) স্বাভাবিক অবস্থার অধীনে, এইচ 2 ও শুধুমাত্র সিএল সঙ্গে মিথস্ক্রিয়া। এবং ক্লিক-পৃথিবী। ধাতু:
2na + 2n + 2 o \u003d 2naoh + H 0 2
CA + 2N + 2 O \u003d CA (ওহ) 2 + এইচ 0 2
খ) উচ্চ তাপমাত্রা এইচ 2 ও প্রতিক্রিয়া এবং অন্য কিছু ধাতু দিয়ে, উদাহরণস্বরূপ:
MG + 2N + 2 O \u003d MG (ওএইচ) 2 + এইচ 0 2
3FE + 4N + 2 O \u003d FE 2 O 4 + 4H 0 2
গ) আলক্লিসের উপস্থিতিতে আল ও জেএন জলে ২ টি পানি ছাড়িয়ে গেছে:
2AL + 6N + 2 O + 2NAOH \u003d 2NA + 3H 0 2
2) অ ধাতুর সাথে মিথস্ক্রিয়া একটি কম eo (প্রতিক্রিয়া কঠোর অবস্থার মধ্যে ঘটতে)
C + N + 2 O \u003d CO + H 0 2 ("জল গ্যাস")
2P + 6N + 2 O \u003d 2HPO 3 + 5H 0 2
আল্কলিশের উপস্থিতিতে, সিলিকন জল থেকে হাইড্রোজেনকে নষ্ট করে দেয়:
Si + N + 2 O + 2naoh \u003d NA 2 SIO 3 + 2H 0 2
3) ধাতু hydrides সঙ্গে মিথস্ক্রিয়া
NAH + H + 2 O \u003d NAOH + H 0 2
CAH 2 + 2N + 2 O \u003d CA (ওএইচ) 2 + 2H 0 2
4) কার্বন মনোক্সাইড এবং মিথেন সঙ্গে মিথস্ক্রিয়া
CO + H + 2 O \u003d CO 2 + H 0 2
2CH 4 + O 2 + 2N + 2 O \u003d 2CO 2 + 6H 0 2
প্রতিক্রিয়া হাইড্রোজেন উত্পাদন শিল্পে ব্যবহার করা হয়।
II। প্রতিক্রিয়া যা পানিতে এজেন্টকে হ্রাস করার ভূমিকা পালন করে
প্রতিক্রিয়াগুলি শুধুমাত্র খুব শক্তিশালী অক্সিডাইজিং এজেন্টের সাথে সম্ভব, যা এস। ও -2 এর সাথে অক্সিজেন অক্সিজেনকে অক্সিজেনকে অক্সিজেনকে অক্সিজেন ও 2 বা পেরক্সাইড-এনে 2-এ বা পেরক্সাইড-আয়ন 2-। একটি ব্যতিক্রমী ক্ষেত্রে (F 2 এর সাথে প্রতিক্রিয়া মধ্যে), অক্সিজেন সি O এর সাথে গঠিত হয়। +2।
1) ফ্লোরিন সঙ্গে মিথস্ক্রিয়া
2F 2 + 2N 2 O-2 \u003d O 0 2 + 4HF
2F 2 + এইচ 2 O-2 \u003d O +2 F 2 + 2HF
2) পারমাণবিক অক্সিজেন সঙ্গে মিথস্ক্রিয়া
এইচ 2 O-2 + O \u003d H 2 O - 2
3) ক্লোরিন সঙ্গে মিথস্ক্রিয়া
উচ্চ টি সঙ্গে, একটি বিপরীত প্রতিক্রিয়া ঘটে
2CL 2 + 2N 2 O-2 \u003d O 0 2 + 4 এইচসিএল
তৃতীয়। Intramolecular অক্সিডেশন প্রতিক্রিয়া - জল পুনরুদ্ধার।
বৈদ্যুতিক বর্তমান বা উচ্চ তাপমাত্রা কর্মের অধীনে, জলের ক্ষয়ক্ষতি হাইড্রোজেন এবং অক্সিজেনের উপর ঘটতে পারে:
2N + 2 O-2 \u003d 2H 0 2 + O 0 2
তাপীয় decomposition - প্রক্রিয়া বিপরীত হয়; জল তাপমাত্রা ডিগ্রী ডিগ্রী ছোট।
হাইড্রেশন প্রতিক্রিয়া
আমি আয়ন হাইড্রেশন। জলবায়ু সমাধানগুলিতে ইলেক্ট্রোলাইটের বিচ্ছিন্নতার সময় গঠিত আয়নগুলি একটি নির্দিষ্ট সংখ্যক পানি অণু সংযুক্ত করে এবং হাইড্রেটেড আয়নগুলির আকারে বিদ্যমান। কিছু আয়নগুলি পানির অণুগুলির সাথে এত শক্তিশালী সংযোগ গঠন করে যা তাদের হাইড্রেটগুলি কেবল সমাধান নয়, বরং একটি কঠিন অবস্থায় থাকতে পারে। এটি টাইপ CUSO4 5H 2 O, FESO 4 7H 2 O, ইত্যাদি, সেইসাথে অ্যাকুইকোমপ্লেক্সের ক্রিস্টালহাইড্রেটগুলির গঠন ব্যাখ্যা করে। সেইসাথে অ্যাকুইকোমপ্লেক্স: সিআই 3, বিআর 4, ইত্যাদি।
II। হাইড্রেশন অক্সাইড

তৃতীয়। একাধিক যোগাযোগ ধারণকারী জৈব যৌগ জলবাহী

Hydrolysis প্রতিক্রিয়া
আমি lalts hydrolysis
বিপরীত hydrolysis:
একটি) লবণ cation দ্বারা
FE 3+ + H 2 O \u003d FEOH 2+ + H +; (সর্বশেষ মাঝারি। পিএইচ
খ) লবণ আয়ন উপর
CO 3 2- + H 2 O \u003d NSO 3 - + এটা -; (ক্ষারীয় পরিবেশ। পিএইচ\u003e 7)
গ) cation এবং anion লবণ অনুযায়ী
এনএইচ 4 + + সি 3 তাই - + এইচ 2 ও \u003d এনএইচ 4 ওহ + সি 3 কক্সি (নিরপেক্ষ থেকে মাঝারি
অপরিবর্তনীয় hydrolysis:
AL 2 S 3 + 6H 2 O \u003d 2al (ওএইচ) 3 ↓ + 3H 2 গুলি
II। ধাতু carbides এর hydrolysis
AL 4 C 3 + 12N 2 O \u003d 4AL (ওএইচ) 3 ↓ + 3CH 4 নেটান
CAC 2 + 2H 2 O \u003d SA (ওএইচ) 2 + সি 2N 2 Acetylene
তৃতীয়। সিলিকাইড hydrolysis, nitrides, phospides
এমজি 2 এসআই + 4N 2 O \u003d 2MG (ওএইচ) 2 ↓ + সিহ 4 সিলান
CA 3 N 2 + 6N 2 O \u003d ZSA (ওএইচ) 2 + 2NH 3 AMMONIA
CU 3 P 2 + 6N 2 O \u003d ZSU (ওএইচ) 2 + 2RN 3 ফসফিন
চতুর্থ। Hydrolysis হ্যালোজেন
CL 2 + H 2 O \u003d HCL + HCLO
B 2 + H 2 O \u003d HBR + NVRO
জিয়া জৈব যৌগ এর virlysysis
জৈব পদার্থের ক্লাস |
Hydrolysis পণ্য (জৈব) |
Halogens (Alkyl Halides) |
|
Arylgoleda. |
|
Digogenelovana. |
Aldehydes বা Ketones. |
ধাতু অ্যালকোহলট |
|
Carboxylic অ্যাসিড Halogenanhydrides |
কারবক্সাইলিক অ্যাসিড |
Carboxylic অ্যাসিড এর anhydrides |
কারবক্সাইলিক অ্যাসিড |
Carboxylic অ্যাসিড জটিল পেইন্টার |
Carboxylic অ্যাসিড এবং অ্যালকোহল |
গ্লিসারিন এবং সর্বোচ্চ carboxylic অ্যাসিড |
|
Di- এবং polysaccharides. |
Monosaccharides. |
Peptides এবং প্রোটিন |
α-amino অ্যাসিড |
নিউক্লিক অ্যাসিড |
|
সংজ্ঞা
পানি - হাইড্রোজেন অক্সাইড - অজৈব প্রকৃতির বাইনারি সংযোগ।
সূত্র - এইচ 2 ও। মোলার ভর - 18 গ্রাম / MOL। এটি তিনটি সমষ্টিগত স্টেটগুলিতে বিদ্যমান থাকতে পারে - তরল (জল), কঠিন (বরফ) এবং গ্যাসীয় (জল বাষ্প)।
পানি রাসায়নিক বৈশিষ্ট্য
জল সবচেয়ে সাধারণ দ্রাবক হয়। জল সমাধান একটি ভারসাম্য আছে, তাই জল একটি ampholite বলা হয়:
এইচ 2 হে ↔ এইচ + + ওহ - ↔ এইচ 3 ও + + ওহ -।
বৈদ্যুতিক বর্তমান কর্মের অধীনে, জল হাইড্রোজেন এবং অক্সিজেন মধ্যে decomposes অধীনে:
এইচ 2 ও \u003d এইচ 2 + ও 2।
রুমের তাপমাত্রায়, জলকে ক্ষারীয় গঠনের জন্য সক্রিয় ধাতু দ্রবীভূত করা হয়, এবং হাইড্রোজেনও প্রকাশ করা হয়:
2 ঘন্টা 2 ও + 2na \u003d 2naoh + এইচ 2।
পানি ফ্লোরাইন এবং মধ্যবর্তী যৌগের সাথে যোগাযোগ করতে সক্ষম, এবং দ্বিতীয় ক্ষেত্রে, প্রতিক্রিয়া হ্রাসের অধীনে প্রতিক্রিয়াগুলি হ্রাস পায়:
2 ঘন্টা 2 ও + 2f 2 \u003d 4HF + O 2।
3 ঘন্টা 2 ও + যদি 5 \u003d 5hf + hio 3।
দুর্বল বেস এবং দুর্বল অ্যাসিড দ্বারা গঠিত লবণ জল দ্রবীভূত যখন hydrolysis অধীন হয়:
AL 2 S 3 + 6H 2 O \u003d 2AL (ওএইচ) 3 ↓ + 3H 2 এস।
জল উত্তাপকালে ধাতু এবং অ ধাতু কিছু পদার্থ দ্রবীভূত করতে সক্ষম হয়:
4H 2 O + 3FE \u003d FE 3 O 4 + 4H 2;
এইচ 2 ও + সি ↔ CO + H 2।
সালফিউরিক অ্যাসিডের উপস্থিতিতে পানি, অসম্পৃক্ত হাইড্রোকার্বনগুলির সাথে ইন্টারঅ্যাকশন (হাইড্রেশন) এর প্রতিক্রিয়ায় প্রবেশ করে - অ্যালকোহলড্রিক অ্যালকোহল তৈরি করতে অ্যালকেনেসগুলি:
সিএইচ 2 \u003d সিএইচ 2 + এইচ 2 ও → সি 3 -চ ২-ওহ।
জলের শারীরিক বৈশিষ্ট্য
পানি একটি স্বচ্ছ তরল (এন।)। ডিপোল মুহুর্তটি 1.84 ডি (অক্সিজেন এবং হাইড্রোজেন বৈদ্যুতিক আলোচনার মধ্যে শক্তিশালী পার্থক্যের কারণে)। তরল এবং কঠিন সমষ্টিগত রাজ্যের সমস্ত পদার্থের মধ্যে নির্দিষ্ট তাপ খরচের সর্বোচ্চ মূল্যের পানি রয়েছে। গলিত পানির নির্দিষ্ট তাপ - 333.25 কেজে / কেজি (0 সি), বাষ্পীকরণ - ২২50 কেজি / কেজি। জল মেরু পদার্থ dissolving করতে সক্ষম। জল একটি উচ্চ পৃষ্ঠ টান এবং নেতিবাচক বৈদ্যুতিক পৃষ্ঠ সম্ভাবনা আছে।
পানি প্রাপ্তি
নিরপেক্ষকরণের প্রতিক্রিয়া দ্বারা পানি প্রাপ্ত হয়, আই। অ্যাসিড এবং alkalis মধ্যে মিথস্ক্রিয়া প্রতিক্রিয়া:
এইচ 2 তাই 4 + 2KOH \u003d K 2 তাই 4 + এইচ 2 ও;
এইচএনও 3 + এনএইচ 4 ওহ \u003d এনএইচ 4 না 3 + এইচ 2 ও;
2CH 3 COOOH + BA (ওহ) 2 \u003d (CH 3 COO) 2 BA + H 2 O.
পানি পাওয়ার উপায়গুলির মধ্যে একটি হল হাইড্রোজেন থেকে তাদের অক্সাইডগুলি থেকে ধাতু পুনরুদ্ধার করা হয়:
Cuo + H 2 \u003d Cu + H 2 ও।
সমস্যা সমাধানের উদাহরণ
উদাহরণ 1।
| কাজটি | অ্যাসেটিক অ্যাসিডের ২0% সমাধান থেকে 5% সমাধান থেকে 5% সমাধান প্রস্তুত করার জন্য কত পানি নেওয়া উচিত? |
| সিদ্ধান্ত | 20% অ্যাসেটিক অ্যাসিড সমাধানের পদার্থের ভর ভগ্নাংশের দৃঢ়তার মতে 80 মিলি দ্রাবক (পানি) ২0 গ্রাম অ্যাসিড এবং 5% অ্যাসেটিক অ্যাসিড সমাধান 95 মিলি দ্রাবক (পানি) 5 গ্রামের 5 গ্রাম। একটি অনুপাত করুন: এক্স \u003d 20 × 95/5 \u003d 380। সেগুলো. একটি নতুন সমাধান (5%), দ্রাবক 380 মিলিমিটার অন্তর্ভুক্ত করা হয়। এটি পরিচিত যে প্রাথমিক সমাধানটি 80 মিলিমিটার দ্রাবক ছিল। অতএব, একটি 20% সমাধান থেকে Acetic অ্যাসিডের 5% সমাধান যোগ করার জন্য: 380-80 \u003d 300 মিলি পানি। |
| উত্তর | পানি 300 মিলিমিটার প্রয়োজন। |
উদাহরণ 2।
| কাজটি | জৈবপদার্থের জ্বলন যখন, 4.8 গ্রামের একটি ভর 3.36 লিটার কার্বন ডাই অক্সাইড (এন .উ.) এবং 5.4 গ্রাম পানি তৈরি করা হয়েছিল। হাইড্রোজেন বরাবর জৈব পদার্থের ঘনত্ব 16. জৈবপদার্থের সূত্র নির্ধারণ করুন। |
| সিদ্ধান্ত | কার্বন ডাই অক্সাইড এবং জলের মোল্লার জনসাধারণ, রাসায়নিক উপাদানগুলির টেবিল ব্যবহার করে গণনা করা হয়। মেন্ডেলিভা - যথাক্রমে 44 এবং 18 গ্রাম / মোল। প্রতিক্রিয়া পণ্য পদার্থের পরিমাণ গণনা করুন: এন (সিও 2) \u003d ভি (সিও 2) / ভি এম; এন (এইচ 2 ও) \u003d এম (এইচ 2 ও) / এম (এইচ 2 ও); এন (সিও 2) \u003d 3.36 / 22.4 \u003d 0.15 মোল; এন (এইচ 2 ও) \u003d 5.4 / 18 \u003d 0.3 MOL। CO 2 অণুগুলির একটি কার্বন পরমাণুগুলির সাথে এবং হাইড্রোজেন পরমাণুগুলির ২ টি অণুগুলির মধ্যে একটি কার্বন পরমাণুগুলির গঠনটি বিবেচনা করে বিবেচনা করা হয়, এই পরমাণুগুলির পদার্থ এবং ভর সমান হবে: এন (সি) \u003d 0.15 মোল; এন (এন) \u003d 2 × 0.3 মোল; এম (সি) \u003d এন (সি) × এম (সি) \u003d 0.15 × 12 \u003d 1.8 গ্রাম; এম (এন) \u003d এন (এন) × এম (এন) \u003d 0.3 × 1 \u003d 0.3 গ্রাম আমরা একটি জৈব পদার্থের অংশ হিসাবে অক্সিজেন আছে কিনা তা সংজ্ঞায়িত করুন: এম (ও) \u003d এম (সি এক্স এইচ ওয়াই জেড) - এম (সি) - এম (এইচ) \u003d 4.8 - 0.6 - 1.8 \u003d 2.4 গ্রাম। অক্সিজেন পরমাণু পদার্থের পরিমাণ: এন (ও) \u003d 2.4 / 16 \u003d 0.15 মোল। তারপর n (c): n (n): n (o) \u003d 0.15: 0.6: 0.15। আমরা ক্ষুদ্রতম মানতে বিভক্ত, আমরা n (c): n (n): n (n): n (o) \u003d 1: 4: 1. তাই, জৈবপদার্থের সূত্র সি 4 ও জৈব পদার্থের মোলার ভর ছিল। রাসায়নিক উপাদান টেবিল ব্যবহার করে গণনা মেন্ডেলিভ - 32 গ্রাম / মোল। জৈবপদার্থের দোলার ভর, তার হাইড্রোজেন ঘনত্বের মান ব্যবহার করে গণনা করা হয়েছে: এম (সি এক্স এইচ ওয়াই ও জেড) \u003d এম (এইচ 2) × ডি (এইচ 2) \u003d 2 × 16 \u003d 32 গ্রাম / mol। জ্বলন পণ্য থেকে প্রাপ্ত জৈবপদার্থের সূত্রগুলি এবং হাইড্রোজেন ঘনত্ব ব্যবহার করে জৈব পদার্থের সূত্রগুলি ভিন্ন হলে, মোল্লার জনগনের অনুপাতটি এর চেয়ে বড় হবে 1. এটি পরীক্ষা করে দেখুন: এম (সি এক্স এইচ ওয়াই ও জেড) / এম (সিএ 4 ও) \u003d 1। ফলস্বরূপ, জৈব পদার্থের সূপাতুলা সিটি 4 ও। |
| উত্তর | জৈব পদার্থের সূত্র CH 4 ও। |
জীবনের ভিত্তিতে সূত্র - পানি ভালভাবে পরিচিত। তার অণু দুটি হাইড্রোজেন পরমাণু এবং এক অক্সিজেন, যা H2O হিসাবে লেখা হয়। যদি অক্সিজেন দ্বিগুণ হয়, তবে একটি সম্পূর্ণ ভিন্ন পদার্থ H2O2 হয়। এটা কি এবং তার ফলে পদার্থ তার "আপেক্ষিক" থেকে ভিন্ন হবে কি?
H2O2 - এই পদার্থ কি?
আসুন আমরা এতে থাকি। H2O2 - হাইড্রোজেন পেরক্সাইড সূত্র, হ্যাঁ, এক যে স্ক্র্যাচ, সাদা সঙ্গে চিকিত্সা করা হয়। হাইড্রোজেন Peroxide H2O2 - বৈজ্ঞানিক।
নির্বীজনের জন্য, পেরক্সাইডের একটি তিন শতাংশ সমাধান ব্যবহার করা হয়। একটি বিশুদ্ধ বা ঘনীভূত ফর্ম, এটি ত্বকের রাসায়নিক পোড়া কারণ। পেরক্সাইডের একটি ত্রিশ শতাংশ সমাধান অন্যথায় perhydro বলা হয়; পূর্বে, তিনি চুল বিবর্ণতা জন্য hairdressers ব্যবহৃত হয়। চামড়া একা বার্ন এছাড়াও সাদা হয়ে যায়।
রাসায়নিক বৈশিষ্ট্য H2O2.
হাইড্রোজেন পেরক্সাইড রঙ ছাড়া একটি তরল এবং একটি "ধাতু" গন্ধ সঙ্গে। এটি একটি ভাল দ্রাবক এবং নিজেই সহজে পানি, ইথার, অ্যালকোহলগুলিতে দ্রবীভূত হয়।
Peroxide এর ছয় শতাংশ সমাধান সাধারণত একটি ত্রিশ শতাংশ সমাধান diluting, প্রস্তুত করা হয়। ঘনীভূত H2O2 সংরক্ষণ করার সময়, অক্সিজেন মুক্তির সাথে পদার্থের একটি সম্প্রসারণ রয়েছে, তাই এটি একটি বিস্ফোরণ এড়ানোর জন্য শক্তভাবে clogged ট্যাংকগুলিতে সংরক্ষণ করা উচিত নয়। পেরক্সাইড ঘনত্ব হ্রাস সঙ্গে, তার স্থিতিশীলতা বৃদ্ধি পায়। H2O2 এর বিচ্ছিন্নতা হ্রাস করার জন্যও, বিভিন্ন পদার্থ এটিতে যোগ করা যেতে পারে, উদাহরণস্বরূপ, ফসফরাস বা সালিসিলিক অ্যাসিড। একটি শক্তিশালী ঘনত্বের সমাধান (90 শতাংশেরও বেশি) এর সমাধান সংরক্ষণের জন্য, সোডিয়াম পিরোফোস্ফটি পেরক্সাইডে যোগ করা হয়, যা পদার্থের অবস্থা স্থির করে এবং অ্যালুমিনিয়াম জাহাজগুলিও ব্যবহার করে।

H2O2 রাসায়নিক প্রতিক্রিয়া একটি অক্সিডাইজিং এজেন্ট এবং একটি হ্রাস এজেন্ট উভয় হতে পারে। তবে, আরো প্রায়ই পেরক্সাইড অক্সিডেটিভ বৈশিষ্ট্য প্রদর্শন করে। পেরক্সাইড অ্যাসিড দিয়ে তৈরি করা হয়, কিন্তু খুব দুর্বল; হাইড্রোজেন পেরক্সাইড লবণ peroxides বলা হয়।
একটি অক্সিজেন উত্পাদন পদ্ধতি হিসাবে
H2O2 এর বিচ্ছিন্নতার প্রতিক্রিয়া ঘটে যখন উচ্চ তাপমাত্রা পদার্থের (150 ডিগ্রি সেলসিয়াসের বেশি) উন্মুক্ত হয়। ফলস্বরূপ, পানি এবং অক্সিজেন গঠিত হয়।
প্রতিক্রিয়া সূত্র - 2 H2O2 + টি -\u003e 2 H2O + O2
অক্সিডেশন ডিগ্রী এইচ 2 ও 2 এবং এইচ 2 O \u003d +1।
অক্সিডেশন ডিগ্রী O: এইচ 2 O 2 \u003d -1, এইচ 2 O \u003d -2, O 2 \u003d 0 এ
2 O-1 - 2E -\u003e O2 0
O -1 + ই -\u003e ও -2
2 H2O2 \u003d 2 H2O + O2
হাইড্রোজেন পেরক্সাইডের বিচ্ছিন্নতা কক্ষ তাপমাত্রায় ঘটতে পারে যদি ক্যাটালাইট ব্যবহার করা হয় (রাসায়নিক প্রতিক্রিয়া ত্বরান্বিত হয়)।
ল্যাবরেটরিজগুলিতে, পানীয়ের লবণ বা ম্যাংকারির বিচ্ছিন্নতা সহ অক্সিজেন উৎপাদনের পদ্ধতিগুলির মধ্যে একটি হল পেরক্সাইড বিচ্ছিন্নতার প্রতিক্রিয়া। এই ক্ষেত্রে, ম্যাগানিজ অক্সাইড (iv) একটি অনুঘটক হিসাবে ব্যবহৃত হয়। H2O2 এর বিচ্ছিন্নতা ত্বরান্বিত অন্যান্য পদার্থগুলি তামার, প্ল্যাটিনাম, সোডিয়াম হাইড্রক্সাইড।
পেরক্সাইড খোলার ইতিহাস
1790 সালে জার্মান আলেকজান্ডার হুম্বোল্টের মাধ্যমে পেরক্সাইড খুলতে প্রথম পদক্ষেপগুলি গরম করার সময় পেরুমাইডে বারিয়াম অক্সাইডের রূপান্তর আবিষ্কার করেছিল। প্রক্রিয়াটি বায়ু থেকে অক্সিজেনের একটি শোষণের সাথে ছিল। বারো বছর পর্যন্ত, টেরেন্ট এবং গে-লুকাকের বিজ্ঞানীরা, একটি অতিরিক্ত অক্সিজেনের সাথে ক্ষারীয় ধাতব জ্বলনতার সাথে অভিজ্ঞতা সম্পন্ন হয়েছিল, যার ফলে সোডিয়াম পেরক্সাইডটি পাওয়া যায়। কিন্তু হাইড্রোজেন পেরক্সাইডটি পরে 1818 সালে প্রাপ্ত হয়েছিল, যখন লুই টেনর ধাতুগুলিতে অ্যাসিডের প্রভাবগুলি অধ্যয়ন করেছিল; তাদের টেকসই মিথস্ক্রিয়া জন্য, একটি নিম্ন পরিমাণ অক্সিজেন প্রয়োজন ছিল। বারিয়াম পেরক্সাইড এবং সালফিউরিক অ্যাসিডের সাথে নিশ্চিত হওয়ার অভিজ্ঞতা পরিচালনা, বিজ্ঞানী তাদের কাছে পানি যোগ করেছেন, হাইড্রোজেন ক্লোরাইড এবং আইস। অল্প সময়ের পর, টেনার বারিয়াম পেরক্সাইডের সাথে ধারকটির দেয়ালের উপর ছোট হিমায়িত ড্রপ আবিষ্কার করেছিলেন। এটা পরিষ্কার হয়ে গেছে যে এটি H2O2। তারপর তারা প্রাপ্ত H2O2 নামটি "অক্সিডাইজড ওয়াটার" দিয়েছে। এটি একটি হাইড্রোজেন পেরক্সাইড ছিল - বর্ণহীন, কোন গন্ধ, হার্ড-প্রশস্ত তরল, ভাল অন্যান্য পদার্থ দ্রবীভূত করা। H2O2 এবং H2O2 এর মিথস্ক্রিয়া ফলাফল একটি বিচ্ছিন্নতা প্রতিক্রিয়া, Peroxide জল দ্রবণীয়।

একটি আকর্ষণীয় ঘটনা - দ্রুত একটি নতুন পদার্থের বৈশিষ্ট্যগুলি আবিষ্কার করা হয়েছে, এটি পুনরুদ্ধারের কাজে এটি ব্যবহার করার অনুমতি দেয়। পেরক্সাইডের সাহায্যে টেনর নিজে, রাফায়েলের ছবিটি পুনরুহেলের ছবিতে পুনরুজ্জীবিত করেছিলেন, সময়-সময়ে অন্ধকার হয়েছিলেন।
XX সেঞ্চুরিতে হাইড্রোজেন পেরক্সাইড
ফলে পদার্থের যত্নশীল গবেষণার পর এটি একটি শিল্প স্কেলে তৈরি করতে শুরু করে। বিংশ শতাব্দীর শুরুতে, ইলেক্ট্রোলিসিস প্রক্রিয়ার উপর ভিত্তি করে পেরক্সাইড উৎপাদন প্রযুক্তির একটি ইলেক্ট্রোকেমিক্যাল উত্পাদন চালু করা হয়েছিল। কিন্তু এই পদ্ধতি দ্বারা প্রাপ্ত পদার্থের শেল্ফ জীবনটি ছোট ছিল, সপ্তাহের এক জোড়া। বিশুদ্ধ পেরক্সাইড অস্থির, এবং বেশিরভাগ ক্ষেত্রে এটি টিস্যু এবং তিন বা ছয় শতাংশে হোয়াইট করার জন্য ত্রিশ শতাংশ ঘনত্বের মধ্যে উত্পাদিত হয়েছিল - পরিবারের চাহিদাগুলির জন্য।
ফ্যাসিবাদী জার্মানির বিজ্ঞানীরা তরল জ্বালানিতে রকেট ইঞ্জিন তৈরির জন্য পেরক্সাইড ব্যবহার করেছিলেন, যা দ্বিতীয় বিশ্বযুদ্ধে প্রতিরক্ষা প্রয়োজনের জন্য ব্যবহৃত হয়েছিল। H2O2 এবং মিথেনল / হাইড্রাজিনের মিথস্ক্রিয়াগুলির ফলে, একটি শক্তিশালী জ্বালানী পাওয়া যায়, যার উপর বিমানটি 950 কিলোমিটার / ঘণ্টা গতিতে পৌঁছেছিল।
এটা H2O2 এখন কোথায় প্রয়োগ করা হয়?
- ঔষধ - ক্ষত প্রসেসিং জন্য;
- সজ্জা এবং কাগজ শিল্পে, পদার্থের whitening বৈশিষ্ট্য ব্যবহার করা হয়;
- টেক্সটাইল শিল্প, প্রাকৃতিক এবং সিন্থেটিক কাপড়, পশম, উল whiten পেরক্সাইড হয়;
- রকেট জ্বালানী বা তার অক্সিডাইজার হিসাবে;
- রসায়ন - একটি ক্যাটাল্ট বা হাইড্রোজেন এজেন্ট হিসাবে porous উপকরণ উত্পাদন জন্য একটি foaming এজেন্ট হিসাবে অক্সিজেন অর্জন করতে;
- নির্বীজন বা পণ্য পরিষ্কারের উত্পাদন জন্য, bleach;
- চুলের বিবর্ণতার জন্য (এটি একটি পুরানো পদ্ধতি, চুলটি পেরক্সাইড দ্বারা দৃঢ়ভাবে ক্ষতিগ্রস্ত হয়);

হাইড্রোজেন পেরক্সাইড সফলভাবে বিভিন্ন পরিবারের কাজ সমাধানের জন্য প্রয়োগ করা যেতে পারে। কিন্তু এই উদ্দেশ্যে আপনি কেবল হাইড্রোজেন পেরক্সাইডের তিন শতাংশ ব্যবহার করতে পারেন। এখানে কিছু উপায় আছে:
- পৃষ্ঠতল পরিষ্কার করার জন্য, আপনাকে Pulverizer এবং দূষিত জায়গায় স্প্রে সঙ্গে একটি পাত্র মধ্যে peroxide ঢালা প্রয়োজন।
- আইটেমের নির্বীজনের জন্য, তারা undiluted H2O2 সমাধান সঙ্গে নিশ্চিহ্ন করা প্রয়োজন। এই ক্ষতিকারক microorganisms থেকে তাদের পরিষ্কার করতে সাহায্য করবে। ওয়াশিংয়ের জন্য স্পঞ্জ পেরক্সাইডের সাথে পানিতে ভিজে যেতে পারে (অনুপাত 1: 1)।
- সাদা জিনিস ধোয়া যখন টিস্যু whitening জন্য, পেরক্সাইড একটি গ্লাস যোগ করা হয়। আপনি গ্লাস H2O2 সঙ্গে মিশ্রিত জল সাদা টিস্যু ক্রল করতে পারেন। এই পদ্ধতিটি হোয়াইটেন্সকে ফেরত দেয়, কল্পনা থেকে কাপড়কে সুরক্ষিত করে এবং শক্ত কাঠের দাগগুলি সরাতে সহায়তা করে।
- ছাঁচ এবং ছত্রাককে মোকাবেলা করতে, 1: ২ এর অনুপাতে একটি স্পেসিং পেরক্সাইড এবং পানির সাথে ট্যাংকগুলিতে মেশান। ফলে মিশ্রণটি দূষিত পৃষ্ঠতলগুলিতে স্প্রে করা হয় এবং 10 মিনিটের পরে তাদের একটি ব্রাশ বা স্পঞ্জ দিয়ে পরিষ্কার করতে হয়।
- টাইলের মধ্যে অন্ধকার grout রিফ্রেশ করুন Peroxide পছন্দসই সাইটগুলিতে স্প্রে করা যেতে পারে। 30 মিনিটের পরে, আপনাকে সাবধানে তাদের কঠোর বুরুশ হারাতে হবে।
- ওয়াশিংয়ের জন্য ফ্ল্যাপ H2O2 জল (বা বন্ধ বেসিনে) সহ মস্তিস্ক সম্পূর্ণ করতে যোগ করুন। কাপ এবং প্লেট যেমন একটি সমাধান মধ্যে ধোয়া পরিচ্ছন্নতা চকমক হবে।
- টুথব্রাশটি পরিষ্কার করার জন্য, আপনাকে এটি পেরক্সাইডের একটি অনির্ধারিত তিন শতাংশ সমাধানে কমিয়ে দিতে হবে। তারপর জল একটি শক্তিশালী জেট অধীনে ধুয়ে নিন। এই পদ্ধতিটি স্বাস্থ্যবিধি বিষয় দ্বারা ভালভাবে নির্বোধ।
- বিক্রেতাদের সবজি ও ফল কেনা, পেরক্সাইডের 1 টি অংশ এবং পানির 1 টি অংশের একটি সমাধান তাদের উপর স্প্রে করা উচিত, তারপরে এটি পুঙ্খানুপুঙ্খভাবে পানি দিয়ে ধৃত হয় (ঠান্ডা হতে পারে)।
- H2O2 এর সাহায্যে দেশের এলাকায়, আপনি উদ্ভিদ রোগের সাথে মোকাবিলা করতে পারেন। চল্লিশ শতাংশ হাইড্রোজেন পেরক্সাইডের সাথে 4.5 লিটার পানিতে 4.5 লিটার পানিতে অবতরণ করার আগেই পেরোক্সাইড বা বীজের একটি সমাধানের সাথে তাদের স্প্রে করা দরকার।
- অ্যাকুইরিয়াম মাছ পুনরুজ্জীবিত করার জন্য, যদি তারা অ্যামোনিয়া বিষাক্ত করে তবে তারা যখন সড়ক অবরোধ করা হয় বা অন্য কারনে থাকে, তখন আপনি হাইড্রোজেন পেরক্সাইডের সাথে তাদের পানি দেওয়ার চেষ্টা করতে পারেন। 100 লিটার প্রতি 30 মিলিমিটার গণনা থেকে তিন শতাংশ পেরক্সাইড মিশ্রিত করা এবং 15-20 মিনিটের ফলে নির্জীব মাছের ফলে মিশ্রণে রাখা দরকার। যদি তারা এই সময়ে পুনরুজ্জীবিত না হয় তবে এর অর্থ এই সরঞ্জামটি সাহায্য করে নি।

এমনকি এটিতে একটি জল বোতল একটি সক্রিয় কম্পন ফলে, একটি সংখ্যা অক্সিজেন সঙ্গে সম্পৃক্ত হয়, যেহেতু অনেক Peroxide গঠিত হয়।
তাজা ফল এবং সবজি মধ্যে, H2O2 এছাড়াও তাপ প্রক্রিয়াকরণের সাপেক্ষে হয় না হওয়া পর্যন্ত H2O2 অন্তর্ভুক্ত করা হয়। যখন উত্তপ্ত, রান্না, রোস্টিং এবং সামঞ্জস্যপূর্ণ উচ্চ তাপমাত্রা সহ অন্যান্য প্রসেসগুলি, প্রচুর পরিমাণে অক্সিজেন ধ্বংস হয়। সেই কারণে পণ্যগুলি রন্ধন প্রক্রিয়াকরণটি পাস করেছে তাই এটি কার্যকর নয়, যদিও কিছু পরিমাণে ভিটামিন তাদের মধ্যে রয়ে যায়। সানটোরিয়ামে সরবরাহকৃত তাজা জুস বা অক্সিজেন ককটেলগুলি একই কারণে উপকারী - অক্সিজেন সম্পৃক্ততার কারণে, যা শরীরকে নতুন বাহিনী দেয় এবং এটি পরিষ্কার করে।
ভিতরে ব্যবহৃত যখন পেরক্সাইড বিপদ
উপরে পরে, মনে হতে পারে যে পেরক্সাইডটি বিশেষভাবে অভ্যন্তরীণভাবে গ্রহণ করা যেতে পারে, এবং এটি শরীরকে উপকৃত করবে। কিন্তু এটা সব না। জল বা রসের মধ্যে, যৌগটি সর্বনিম্ন পরিমাণে এবং অন্যান্য পদার্থের সাথে ঘনিষ্ঠভাবে যুক্ত হয়। "অপ্রাসঙ্গিক" হাইড্রোজেন পেরক্সাইডের ভিতরে (এবং দোকানের মধ্যে কেনা সমস্ত রেসক্সাইডটি স্বাধীনভাবে প্রাকৃতিক পরীক্ষার ফলে তৈরি করা যায় না, তাছাড়াও, এটি প্রাকৃতিক তুলনায় খুব বেশি ঘনত্ব রয়েছে) জীবনযাত্রার হুমকির সম্মুখীন হতে পারে) স্বাস্থ্য পরিণতি। বুঝতে হবে - কেন, আপনি আবার রসায়ন চালু করতে হবে।
ইতিমধ্যে উল্লেখ করা হয়েছে, নির্দিষ্ট অবস্থার অধীনে, হাইড্রোজেন পেরক্সাইডটি ধ্বংস হয়ে গেছে এবং অক্সিজেন বিশিষ্ট, যা একটি সক্রিয় অক্সিডাইজিং এজেন্ট। এটি Peroxidase সহ H2O2 সংঘর্ষে ঘটতে পারে - একটি intracellular এনজাইম। এটি নির্বীজন জন্য পরিপূর্ণতা ব্যবহার উপর ভিত্তি করে। এটা তার অক্সিডেটিভ বৈশিষ্ট্য। সুতরাং, যখন ক্ষতটি H2O2 এর সাথে চিকিত্সা করা হয় - নির্গমন অক্সিজেন এটির মধ্যে পতিত জীবিত রোগজনিত মাইক্রোজোজিজমকে ধ্বংস করে। এটি অন্যান্য জীবন্ত কোষে একই কর্ম আছে। আপনি যদি অক্ষত পেরোক্সাইড স্কিনের সাথে আচরণ করেন এবং তারপরে অ্যালকোহল, বার্নিং সংবেদনের সাথে প্রক্রিয়াকরণের স্থানটি নিশ্চিহ্ন করে, যা পেরক্সাইডের পরে মাইক্রোস্কোপিক ক্ষতির উপস্থিতি নিশ্চিত করে। কিন্তু পেরক্সাইডের বাহ্যিক অ্যাপ্লিকেশনের সাথে, কিছু উল্লেখযোগ্য ক্ষতির একটি কম ঘনত্ব হিসাবে প্রাণবন্ত হবে না।

আরেকটি জিনিস, যদি আপনি ভিতরে এটি নিতে চেষ্টা করুন। তারপরে এমন পদার্থ যা এমনকি অপেক্ষাকৃত পুরু ত্বকের ক্ষতিকর করতে সক্ষম, পাচক ট্র্যাক্টের শ্বসন ঝিল্লিগুলিতে পড়ে। যে, রাসায়নিক মিনি-পোড়া ঘটে। অবশ্যই, নির্গত অক্সিডাইজার অক্সিজেন - একই সময়ে ক্ষতিকারক জীবাণু মারা যেতে পারে। কিন্তু একই প্রক্রিয়াটি খাদ্যের ট্র্যাকের কোষের সাথে ঘটবে। অক্সিডেন্টের কর্মের ফলে পোড়া বারবার পুনরাবৃত্তি হয়, তবে শ্লৈষ্মিক ঝিল্লির অ্যাট্রোফিটি সম্ভব, এবং এটি ক্যান্সারের প্রথম পদক্ষেপ। অন্ত্রের কোষগুলির মৃত্যু শরীরের অসম্ভাব্যতা শোষণ করার জন্য শরীরের অসম্ভবতার দিকে পরিচালিত করে, উদাহরণস্বরূপ, Peroxide দ্বারা "চিকিত্সা" অনুশীলনকারী কিছু মানুষের মধ্যে কোষ্ঠকাঠিন্যের ওজন এবং অন্তর্ধানের একটি হ্রাস।
আলাদাভাবে, Peroxide ড্রিংক ইনজেকশন হিসাবে পানীয় করার একটি পদ্ধতি সম্পর্কে বলতে হবে। এমনকি ডাক্তারের কোন কারণে ডাক্তার নির্ধারিত ছিল (যখন কোনও উপযুক্ত ওষুধের কোনও উপযুক্ত ওষুধের সাথে রক্ত \u200b\u200bসংক্রামিত হয় তবে এটি কেবলমাত্র ন্যায্য হতে পারে, তারপর চিকিৎসা তত্ত্বাবধানে এবং ডোজগুলির কঠোর হিসাবের অধীনে ঝুঁকিগুলি এখনও আছে। কিন্তু এই ধরনের চরম অবস্থায় এটি পুনরুদ্ধারের জন্য একটি সুযোগ হবে। এটি একটি হাইড্রোজেন পেরোক্সাইড ইনজেকশন নিজেই নিযুক্ত করা অসম্ভব। H2O2 রক্তের কোষগুলির একটি বৃহত্তর বিপদ - Erythrocytes এবং Platelets, রক্ত \u200b\u200bপ্রবাহ প্রবেশ করার সময় তাদের ধ্বংস। উপরন্তু, মুক্তিপ্রাপ্ত অক্সিজেন দ্বারা জাহাজের একটি মারাত্মক বিপজ্জনক বাধা হতে পারে - গ্যাস embolism।
H2O2 হ্যান্ডলিং নিরাপত্তা ব্যবস্থা
- শিশুদের নাগালের বাইরে এবং মুখ অপমানিত। গন্ধ এবং উচ্চারিত স্বাদ অনুপস্থিতি পেরক্সাইডটি তাদের জন্য বিশেষভাবে বিপজ্জনক করে তোলে, কারণ বড় ডোজ নেওয়া যেতে পারে। যদি আপনি সমাধানটি ভিতরে পান তবে ব্যবহারের প্রভাবগুলি অনির্দেশ্য হতে পারে। অবিলম্বে একটি ডাক্তারের সাথে পরামর্শ করা প্রয়োজন।
- ত্বকের প্রবেশ করার সময় তিন শতাংশের বেশি কারণের ঘনত্বের সাথে পেরক্সাইড সমাধানগুলি পোড়াচ্ছে। দৃশ্য প্রচুর পানি দিয়ে rinsed করা আবশ্যক।

- Peroxide সমাধান প্রবেশ করতে, তাদের ফুসকুড়ি, লালসা, জ্বালা, কখনও কখনও ব্যথা হিসাবে প্রবেশ করতে পারবেন না। ডাক্তারের কাছে আবেদন করার আগে প্রথম সাহায্য - প্রচুর পরিমাণে চোখে চোখে চোখে চোখ।
- পদার্থটি সংরক্ষণ করুন যাতে এটি স্পষ্ট যে এটি H2O2 হয়, অর্থাৎ, দুর্ঘটনাক্রমে প্রয়োগ করা এড়াতে একটি স্টিকারের সাথে একটি ধারক।
- স্টোরেজ শর্তাবলী তার মেয়াদ দীর্ঘায়িত - অন্ধকার, শুষ্ক, শীতল জায়গা।
- হাইড্রোজেন পেরক্সাইডকে কোনও তরল মিশ্রিত করা অসম্ভব, বিশুদ্ধ পানি ছাড়াও, ক্লোরিনযুক্ত পানি সহ ক্লোরিনযুক্ত পানির সাথে ট্যাপের অধীনে।
- উপরের সমস্তগুলি শুধুমাত্র H2O2 নয়, বরং এর সমস্ত প্রস্তুতিগুলিতেও প্রযোজ্য।
, জিপসাম, ইত্যাদি) মাটি উপস্থিত, বাধ্য। সব জীবন্ত প্রাণীর উপাদান।
আইসোটোপিক রচনা।জলের 9 স্থিতিশীল আইসোটোপিক জাতের আছে। তাজা জল তাদের রক্ষণাবেক্ষণ নিম্নলিখিত (MOL।%): 1N 2 16 O - 99.13; 1 এইচ 2 18 ও - 0.2; 1 এইচ 2 17 0-0.04; 1 এইচ 2 ও 16 O-0.03; অবশিষ্ট পাঁচটি আইসোটোপের জাতের মধ্যে অসম্পূর্ণ গণনা পানিতে উপস্থিত রয়েছে। স্থিতিশীল আইসোটোপিক জাতের পাশাপাশি, পানিতে একটি ছোট পরিমাণ তেজস্ক্রিয় 3 এইচ 2 (বা টি 2 ও) রয়েছে। বিভিন্ন উৎপাদনের প্রাকৃতিক পানির আইসোটোপিক রচনা। পরিবর্তিত হয়। 1 এন / 2 এন এর অনুপাতটি বিশেষত impermanently: তাজা জলের মধ্যে - গড় 6900, সমুদ্রের পানিতে -5500, বরফ - 5500-9000। শারীরিক উপর ডি 2 o এর বৈশিষ্ট্যগুলি সাধারণ পানির (ভারী পানি দেখুন) থেকে উল্লেখযোগ্যভাবে ভিন্ন। 16 টির মধ্যে রয়েছে পানি, আপনার কাছে 16 থেকে পানি কাছাকাছি আপনার কাছে।
শারীরিক। জল ব্যতিক্রম বৈশিষ্ট্য। ময়লা বরফ এটিএম। চাপ 9% দ্বারা ভলিউম হ্রাস দ্বারা সংসর্গী হয়। তাপমাত্রার গুণাঙ্ক. আইস এবং তরল পানির ভলিউম সম্প্রসারণ টি-প্যাক এসি এ নেতিবাচক। নিচে -210 ডিগ্রি সেলসিয়াস এবং 3.98 ডিগ্রি সেলসিয়াস। ময়লা থেকে তাপমাত্রা থেকে তাপমাত্রা প্রায় দ্বিগুণ বৃদ্ধি পায় এবং 0-100 ডিগ্রি সেলসিয়াসে টি-রাইয়ের (35 ডিগ্রি সেলসিয়াসে পাওয়া যায়। নূন্যতম আইএসও-তাপীয়। সংকোচনীয়তা (44.9 * 10 -11 PA -1), 46 ডিগ্রি সেলসিয়াসে পর্যবেক্ষণ করা হয়েছে, এটি বেশ স্পষ্টভাবে প্রকাশ করা হয়েছে। কম চাপ এবং টি-ছাঙ্গায় 30 ডিগ্রি সেলসিয়াস পর্যন্ত, ক্রমবর্ধমান চাপ ড্রপ দিয়ে পানির সান্দ্রতা। উচ্চ dielectecric। পানির পারমিবিলিটি এবং ডিপোল মুহূর্তটি আপনি পোলার এবং আইওনিকের প্রতি শ্রদ্ধার সাথে তার ভাল দ্রবীভূত করার ক্ষমতা নির্ধারণ করেন। ° উচ্চ মূল্যের কারণে, এবং জল-গুরুত্বপূর্ণ জলবায়ু নিয়ন্ত্রক। পৃথিবীতে শর্ত, তার পপ উপর টি-রুশ স্থিতিশীল। উপরন্তু, এন-ওহ কোণের নিকটবর্তী (109 ° ২8 ") এর নিকটবর্তীতা (109 ° ২8") বরফের কাঠামো এবং তরল পানির অলঙ্কার সৃষ্টি করে এবং ফলস্বরূপ, টি-রাই থেকে ঘনত্বের অস্বাভাবিক নির্ভরতা। অতএব, বড় জলাধার হয় নিচের দিকে অসহায় নয়, যা তাদের জীবনে বিদ্যমান থাকতে পারে।
টেবিল। 1 - ভারসাম্য মধ্যে জল এবং জল বাষ্প বৈশিষ্ট্য 

কিন্তু পরিবর্তনের ঘনত্ব ২-VI এর চেয়ে উল্লেখযোগ্যভাবে কম, যার মাধ্যমে বরফের অণুগুলির একটি ঘনত্বের প্যাকেজিং থাকতে পারে। শুধুমাত্র পরিবর্তনশীলতা VII এবং VIII মধ্যে, একটি মোটামুটি উচ্চ প্যাকেজিং ঘনত্ব অর্জন করা হয়: তাদের কাঠামোতে, দুইটি সঠিক গ্রিডগুলি তেত্রহেদ্রা থেকে নির্মিত (ঘন-তাপমাত্রা বরফ, iso o oोस्प्टुंट হীরা), একে অপরকে; একই সময়ে, rectilinear হাইড্রোজেন বন্ড একটি সিস্টেম সংরক্ষিত, এবং সমন্বয় করা হয়। অক্সিজেন নম্বর দ্বিগুণ হয় এবং পৌঁছেছে 8. বরফ VII এবং VIII এ অক্সিজেন পরমাণু অবস্থানগুলি IRRERPRERSURE এর পরমাণুগুলির অবস্থান এবং অনেক অন্যান্য ধাতুগুলির মতো। স্বাভাবিক (আইএইচ) এবং ঘনক (আইসি) বরফের পাশাপাশি বরফ হাই, ভি-ভিআইআই-তে, অণুগুলির অভিযোজন সংজ্ঞায়িত করা হয় না: প্রোটন পরমাণু উভয়ই প্রোটন পরমাণু সম্পর্কে একটি সমবায় বন্ড তৈরি করার জন্য গঠিত হয় । Tetrahedra শীর্ষে চারটি প্রতিবেশী অক্সিজেন পরমাণুতে দুটি নির্দেশিত। ডায়ালেকট্রিক। এই পরিবর্তনগুলির permeability উচ্চ (তরল জলের চেয়ে বেশি)। সংশোধন II, VIII এবং IX অভিযোজন আদেশ দেওয়া হয়েছে; তাদের dielectric। Permeability কম (প্রায় 3)। বরফ VIII প্রোটন বসানো আইস VII এর একটি ঐচ্ছিক সংস্করণ, এবং আইস আইএক্স III III। ভিত্তিক আদেশযুক্ত সংশোধন (viii, ix) এর ঘনত্ব সংশ্লিষ্ট বিকৃত (vii, iii) এর ঘনত্বের কাছাকাছি।
একটি দ্রাবক হিসাবে জল। জল ভাল mn dissolves। ধ্রুবক এবং আয়ন মধ্যে dissociating। সাধারণত, পি-নির্ভরযোগ্যতা টি-রাইয়ের বৃদ্ধির সাথে বৃদ্ধি পায়, তবে কখনও কখনও তাপমাত্রা নির্ভরতা আরও জটিল। সুতরাং, r-নির্ভরযোগ্যতা mn। Sulfates, কার্বনেট এবং ফসফেট টি-রি হ্রাস বা প্রথম উত্থান সঙ্গে, এবং তারপর সর্বোচ্চ মাধ্যমে পাস। পানিতে কম-পোলার ইন-ইন-ইন (বায়ুমন্ডলের অংশ, যা বায়ুমন্ডলের অংশ সহ) বিকিরণ কম এবং যখন টি-রি বৃদ্ধি করে তখন সাধারণত হ্রাস পায় এবং তারপরে সর্বনিম্নের মধ্য দিয়ে যায়। ক্রমবর্ধমান চাপের সাথে, গ্যাসের r-নির্ভরযোগ্যতা বৃদ্ধি পায়, সর্বাধিক পরে উচ্চ চাপে ক্ষণস্থায়ী হয়। ভিএতে অনেকে, পানিতে দ্রবীভূত করা, এর সাথে প্রতিক্রিয়া জানান। উদাহরণস্বরূপ, এনএইচ 4 আয়ন P-Rax এনএইচ 3 (এছাড়াও hydrolysis দেখুন) উপস্থিত হতে পারে। আয়ন, পরমাণু, অণু তার মধ্যে প্রবেশ না করে পানি মধ্যে দ্রবীভূত মধ্যে দ্রবীভূত মধ্যে। রেশন এবং