คุณสมบัติทางเคมีคลอรีน วิธีคลอรีนของการได้รับคลอรีน คลอรีนที่ไม่สมส่วนในน้ำและน้ำโซลูชั่นอัลคาไลน์
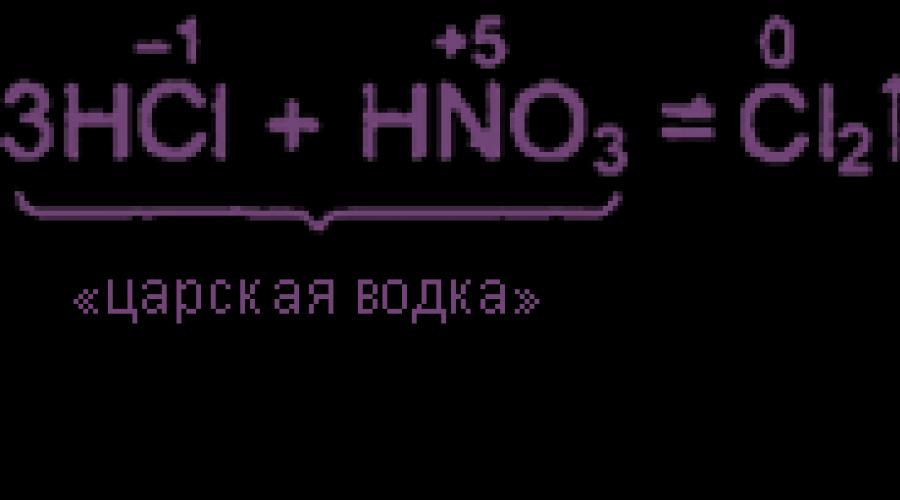
คำนิยาม
คลอรีน - องค์ประกอบทางเคมี VII Group 3 ระบบเป็นระยะขององค์ประกอบทางเคมี D.I mendeleeva ไม่ใช่โลหะ
หมายถึงองค์ประกอบ - P-family ฮาโลเจน หมายเลขซีเรียล - 17. โครงสร้างของระดับอิเล็กทรอนิกส์ภายนอกคือ 3S 2 3 P 5 มวลอะตอมสัมพัทธ์ - 35.5 AEM คลอรีนโมเลกุลคู่ - CL 2
คุณสมบัติทางเคมีคลอรีน
คลอรีนทำปฏิกิริยากับโลหะง่าย ๆ :
CL 2 + 2SB \u003d 2SBCL 3 (T);
CL 2 + 2FE \u003d 2Fecl 3;
CL 2 + 2NA \u003d 2NACL
คลอรีนมีปฏิสัมพันธ์กับสารที่ไม่ใช่โลหะที่เรียบง่าย ดังนั้นเมื่อมีปฏิสัมพันธ์กับฟอสฟอรัสและซัลเฟอร์คลอไรด์ที่เหมาะสมเกิดขึ้นกับฟลูออไรด์ - ฟลูออไรด์ด้วยไฮโดรเจน - คลอไรด์ไฮโดรเจนด้วยออกซิเจน - ออกไซด์ ฯลฯ :
5CL 2 + 2P \u003d 2HCL 5;
CL 2 + 2S \u003d SCL 2;
CL 2 + H 2 \u003d 2HCL;
CL 2 + F 2 \u003d 2CLF
คลอรีนสามารถแทนที่โบรมีนและไอโอดีนจากสารประกอบของพวกเขาด้วยไฮโดรเจนและโลหะ:
CL 2 + 2HBR \u003d BR 2 + 2HCL;
CL 2 + 2NAI \u003d I 2 + 2NACL
คลอรีนสามารถละลายในน้ำและด่างในขณะที่ปฏิกิริยาของคลอรีนไม่สมส่วนเกิดขึ้นและองค์ประกอบของผลิตภัณฑ์ปฏิกิริยาขึ้นอยู่กับเงื่อนไขของมัน:
CL 2 + H 2 O ↔ HCL + HCLO;
CL 2 + 2NAOH \u003d NACL + NACLO + H 2 O;
3 CL 2 + 6NAOH \u003d 5NACL + NACLO 3 + 3H 2 O.
คลอรีนโต้ตอบกับการไม่ก่อตัวออกไซด์ - ด้วยการก่อตัวของสารที่มีชื่อเล็กน้อย - ฟอสกาเนียนกับแอมโมเนียในการสร้างแอมโมเนียมไตรคลอไรด์:
CL 2 + CO \u003d COCL 2;
3 CL 2 + 4NH 3 \u003d NCL 3 + 3NH 4 CL.
ในปฏิกิริยาคลอรีนแสดงคุณสมบัติของอนุมูลอิสระ:
CL 2 + H 2 S \u003d 2HCL + S.
คลอรีนเข้าสู่ปฏิกิริยาของการมีปฏิสัมพันธ์กับสารอินทรีย์ของคลาสของ Alkanes, Alkenes และ Arena:
CH 3 -CH 3 + CL 2 \u003d CH 3 -CH 2 -CL + HCL (เงื่อนไข - รังสียูวี);
CH 2 \u003d CH 2 + CL 2 \u003d CH 2 (CL) -CH 2 -CL;
C 6 H 6 + CL 2 \u003d C 6 H 5 -CL + HCL (KAT \u003d FECL 3, ALCL 3);
C 6 H 6 + 6CL 2 \u003d C 6 H 6 CL 6 + 6HCL (เงื่อนไข - รังสียูวี)
คุณสมบัติทางกายภาพคลอรีน
คลอรีน - ก๊าซสีเหลืองสีเขียว มีเสถียรภาพ เมื่อคลอไรด์อิ่มตัวด้วยคลอรีนมีการสร้างความสงบสุขที่เป็นของแข็ง มันละลายได้ดีในน้ำละลาย ("น้ำคลอรีน") ส่วนใหญ่สัมผัสกับระดับใหญ่ คาร์บอน Tetrachloride ถูกละลาย Liquid Sicl 4 และ Ticl 4 ละลายไม่ดีในการแก้ปัญหาอิ่มตัวของโซเดียมคลอไรด์ ไม่ตอบสนองด้วยออกซิเจน ออกซิไดเซอร์ที่แข็งแกร่ง จุดเดือด - -34.1C ละลาย - -101,03C
รับคลอรีน
ก่อนหน้านี้คลอรีนได้รับจากวิธีการของเชลเล่ (ปฏิกิริยาของการมีปฏิสัมพันธ์ของแมงกานีสออกไซด์ (VI) กับกรดไฮโดรคลอริก) หรือโดยวิธี DICON (ปฏิกิริยาของการมีปฏิสัมพันธ์ของ Chloroodor กับออกซิเจน):
MNO 2 + 4HCL \u003d MNCL 2 + CL 2 + 2H 2 O;
4HCL + O 2 \u003d 2H 2 O + 2 CL 2
ทุกวันนี้ปฏิกิริยาต่อไปนี้ใช้เพื่อรับคลอรีน:
Naocl + 2HCL \u003d NACL + CL 2 + H 2 O;
2KMNO 4 + 16HCL \u003d 2KCL + 2MNCL 2 +5 CL 2 + 8H 2 O;
2NACL + 2H 2 O \u003d 2NAOH + CL 2 + H 2 (เงื่อนไข - อิเล็กโทรไลซิส)
การใช้คลอรีน
คลอรีนถูกนำมาใช้กันอย่างแพร่หลายในด้านต่าง ๆ ของอุตสาหกรรมดังนั้นจึงใช้ในการผลิตวัสดุโพลีเมอร์ (โพลีไวนิลคลอไรด์), ฟอกสี, ยาฆ่าแมลงคลอโรคอรริสถ์ (Hexahloraran), สารพิษต่อสู้ (ฟอสเจ,) สำหรับการฆ่าเชื้อโรคในน้ำในอุตสาหกรรมอาหาร ในโลหะผสม ฯลฯ
ตัวอย่างของการแก้ปัญหา
ตัวอย่างที่ 1
ตัวอย่างที่ 2
| งาน | ปริมาณ, มวลและปริมาณของสารคลอรีนถูกเน้น (n.u. ) ด้วยการมีปฏิสัมพันธ์ที่ 17.4 กรัมของแมงกานีสออกไซด์ (IV) ที่มีกรดไฮโดรคลอริกที่เกิน? |
| การตัดสินใจ | เราเขียนสมการของปฏิกิริยาของการมีปฏิสัมพันธ์ของแมงกานีสออกไซด์ (IV) กับกรดไฮโดรคลอริก: 4HCL + MNO 2 \u003d MNCL 2 + CL 2 + 2H 2 O. Molar Manses of Manganese Oxide (IV) และคลอรีนคำนวณโดยใช้ตารางองค์ประกอบทางเคมี D.I Mendeleeva - 87 และ 71 g / mol ตามลำดับ คำนวณปริมาณของ Mangand Oxide (IV): n (MNO 2) \u003d M (MNO 2) / m (MNO 2); n (MNO 2) \u003d 17.4 / 87 \u003d 0.2 mol ตามสมการปฏิกิริยา n (MNO 2): N (CL 2) \u003d 1: 1 ดังนั้น N (CL 2) \u003d N (MNO 2) \u003d 0.2 mol จากนั้นมวลและปริมาตรของคลอรีนจะเท่ากัน: m (CL 2) \u003d 0.2 × 71 \u003d 14.2 กรัม; V (CL 2) \u003d N (CL 2) × V M \u003d 0.2 × 22,4 \u003d 4,48 ลิตร |
| ตอบ | ปริมาณของสารคลอรีนคือ 0.2 mol น้ำหนัก - 14.2 กรัม, ปริมาตร - 4.48 ลิตร |
cl 2 เกี่ยวกับ T - ก๊าซสีเหลืองสีเขียวที่มีกลิ่นสับที่คมกว่าอากาศ 2.5 เท่าในน้ำในน้ำ (~ 6.5 g / l); x. อาร์ ในตัวทำละลายอินทรีย์ที่ไม่ใช่ขั้วโลก น้ำท่วมพบได้เฉพาะในก๊าซภูเขาไฟ
วิธีการรับ
ขึ้นอยู่กับกระบวนการออกซิเดชั่นของไอออนไอเอ็นโดล -
2CL - - 2E - \u003d CL 2 0
อุตสาหกรรม
กระแสไฟฟ้าของสารละลายที่เป็นน้ำของคลอไรด์บ่อยขึ้น - NACL:
2NACL + 2N 2 O \u003d CL 2 + 2NAOH + H 2
ห้องปฏิบัติการ
ออกซิเดชัน Conc เอชซีไอสารออกซิไดซ์ต่าง ๆ :
4HCI + MNO 2 \u003d CL 2 + MPCL 2 + 2N 2 O
16NSL + 2KMPO 4 \u003d 5CL 2 + 2MNCL 2 + 2KCL + 8N 2 O
6HCL + KSLO 3 \u003d SCL 2 + KCL + 3N 2 O
14HCL + K 2 CR 2 O 7 \u003d 3CL 2 + 2Crcl 3 + 2KCL + 7N 2 O
คุณสมบัติทางเคมี
คลอรีนเป็นตัวแทนออกซิไดซ์ที่แรงมาก ออกซิไดซ์โลหะที่ไม่ใช่โลหะและสารที่ซับซ้อนซึ่งกลายเป็นแคลไอออนที่มีความเสถียรมาก -:
CL 2 0 + 2E - \u003d 2CL -
ปฏิกิริยากับโลหะ
โลหะที่ใช้งานอยู่ในบรรยากาศของคลอรีนก๊าซแห้งถูกจุดประกายและเผา; ในเวลาเดียวกันคลอไรด์ของโลหะเกิดขึ้น
CL 2 + 2NA \u003d 2NACL
3CL 2 + 2FE \u003d 2Fecl 3
โลหะที่ไม่มีประสิทธิภาพนั้นง่ายต่อการออกซิไดซ์ด้วยคลอรีนเปียกหรือโซลูชั่นน้ำ:
CL 2 + Cu \u003d Cucl 2
3CL 2 + 2AU \u003d 2AUCL 3
ปฏิกิริยากับ non-metals
คลอรีนไม่ได้มีปฏิสัมพันธ์โดยตรงกับ O 2, N 2, C. กับอีกโลหะที่ไม่ใช่โลหะของปฏิกิริยาเกิดขึ้นภายใต้เงื่อนไขที่แตกต่างกัน
Nemmetalov Halides เกิดขึ้น ที่สำคัญที่สุดคือปฏิกิริยาของการมีปฏิสัมพันธ์กับไฮโดรเจน
CL 2 + H 2 \u003d 2NC1
CL 2 + 2S (ละลาย) \u003d S 2 CL 2
ZCL 2 + 2R \u003d 2pcl 3 (หรือ PCL 5 - ในส่วนเกิน CL 2)
2CL 2 + SI \u003d SICL 4
3CL 2 + I 2 \u003d 2ICL 3
การแทนที่ Non-Metals (BR 2, I 2, N 2, S) จากสารประกอบของพวกเขา
CL 2 + 2KBR \u003d BR 2 + 2KCL
CL 2 + 2KI \u003d I 2 + 2KCL
CL 2 + 2HI \u003d I 2 + 2HCL
CL 2 + H 2 S \u003d S + 2HCL
ZSL 2 + 2NH 3 \u003d N 2 + 6HCL
คลอรีนที่ไม่สมส่วนในน้ำและน้ำโซลูชั่นอัลคาไลน์
อันเป็นผลมาจากการรักษาด้วยตนเอง - การรักษาด้วยตนเองอะตอมคลอรีนบางตัวจะถูกแปลงเป็น CL - และอื่น ๆ ในระดับบวกของการเกิดออกซิเดชันรวมอยู่ใน Clo หรือ Clo 3 Enions
CL 2 + H 2 O \u003d HCL + HCLO Hlornoty K-ta
CL 2 + 2Con \u003d KCL + KCLO + H 2 O
3CL 2 + 6Con \u003d 5KCL + KCLO 3 + 3N 2 O
3CL 2 + 2S (IT) 2 \u003d CACL 2 + CA (CLO) 2 + 2N 2 O
ปฏิกิริยาเหล่านี้มีความสำคัญเนื่องจากได้รับสารออกซิเจนคลอรีน:
KCLO 3 และ CA (Clo) 2 - hypochlorites; KCLO 3 - โพแทสเซียมคลอโรต (เกลือ burtupolet)
ปฏิสัมพันธ์ของคลอรีนกับสารอินทรีย์
a) การเปลี่ยนอะตอมไฮโดรเจนในโมเลกุล
b) การเพิ่มโมเลกุล CL 2 ในสถานที่ของการทำลายความสัมพันธ์คาร์บอนหลายชนิด
H 2 C \u003d CH 2 + CL 2 → CLH 2 C-CH 2 CL 1,2-Dichloroethane
HC≡CH + 2CL 2 → CL 2 HC-CHCL 2 1,1,2,2-Tetrachloroethane
กรดคลอไรด์และไฮโดรคลอริก
คลอไรด์ก๊าซ
คุณสมบัติทางกายภาพและทางเคมี
hcl - ไฮโดรเจนคลอไรด์ เกี่ยวกับ T - BESZV ก๊าซที่มีกลิ่นที่คมชัดค่อนข้างเหลวไหลได้ง่าย (t. p. -114 ° c, ยากมาก -85 ° C) ANHYDROUS HCL และก๊าซและในสภาพที่เป็นของเหลวที่ไม่ใช่ไฟฟ้านำไฟฟ้า, เฉื่อยทางเคมีที่เกี่ยวข้องกับโลหะ, ออกไซด์และ hydroxides ของโลหะรวมถึงสารอื่น ๆ อีกมากมาย ซึ่งหมายความว่าในกรณีที่ไม่มีน้ำคลอไรด์ไม่แสดงคุณสมบัติของกรด เฉพาะกับ HCL ที่สูงมาก HCl ตอบสนองด้วยโลหะและแม้กระทั่งการใช้งานต่ำในฐานะ CU และ AG
คุณสมบัติการฟื้นฟูของ horid-anion ใน HCL ยังปรากฏในระดับเล็กน้อย: มันถูกออกซิไดซ์โดยฟลูออรีนที่เกี่ยวกับ T เช่นเดียวกับที่สูง (600 ° C) ในการปรากฏตัวของตัวเร่งปฏิกิริยาตอบสนองต่อการทำปฏิกิริยากับออกซิเจน:
2HCL + F 2 \u003d CL 2 + 2HF
4HCL + O 2 \u003d 2SL 2 + 2N 2 O
ก๊าซ HCL ใช้กันอย่างแพร่หลายในการสังเคราะห์สารอินทรีย์ (ปฏิกิริยาไฮโดรคลอรีน)
วิธีการรับ
1. การสังเคราะห์สารง่าย ๆ :
H 2 + CL 2 \u003d 2HCL
2. มันก่อตัวเป็นผลพลอยได้เมื่อ chloring hc:
R-H + CL 2 \u003d R-CL + HCL
3. ในห้องปฏิบัติการได้มาจากคอนกรีต h 2 ดังนั้น 4 สำหรับคลอไรด์:
H 2 ดังนั้น 4 (CONC.) + NACL \u003d 2HCL + NAHSO 4 (ด้วยความร้อนที่อ่อนแอ)
H 2 ดังนั้น 4 (CONC.) + 2NACL \u003d 2HCL + NA 2 SO 4 (ด้วยความร้อนที่แข็งแกร่งมาก)
สารละลายน้ำ HCL - กรดรุนแรง (คลอไรด์หรือไฮโดรคลอริก)
HCL ที่ละลายได้ดีในน้ำ: สำหรับเกี่ยวกับ t 1 l h 2 o ถูกละลายก๊าซ ~ 450 ลิตร (การสลายตัวจะมาพร้อมกับการเปิดตัวความร้อนจำนวนมาก) สารละลายอิ่มตัวมีจำนวนมากของ HCL เท่ากับ 36-37% วิธีนี้มีกลิ่นที่คมชัดมากและหายใจไม่ออก
โมเลกุลของ HCL ในน้ำนั้นพังทลายลงอย่างสมบูรณ์โดยไอออน, I. , สารละลายน้ำของ HCl เป็นกรดแก่
คุณสมบัติทางเคมีของกรดไฮโดรคลอริก
1. น้ำละลายในน้ำ HCL จัดแสดงคุณสมบัติทั่วไปทั้งหมดของกรดเนื่องจากการปรากฏตัวของ H + ไอออน
HCL → H + + CL -
การโต้ตอบ:
a) กับโลหะ (BC):
2HCL 2 + ZN \u003d ZNCL 2 + H 2
b) ด้วยการออกไซด์พื้นฐานและ amphoteric:
2HCL + CUO \u003d CUCL 2 + H 2 O
6HCL + AL 2 O 3 \u003d 2ALCL 3 + ZN 2 O
c) กับฐานและ hydroxides amphoteric:
2HCL + SA (IT) 2 \u003d CACL 2 + 2N 2 O
3hcl + al (it) 3 \u003d alsl 3 + zn 2 o
d) ด้วยเกลือของกรดที่อ่อนแอกว่า:
2HCL + SACO 3 \u003d CACL 2 + CO 2 + H 3 O
HCL + C 6 H 5 ONA \u003d C 6N 5 ON + NACL
e) กับแอมโมเนีย:
HCL + NH 3 \u003d NH 4 CL
ปฏิกิริยากับสารออกซิไดซ์ที่แข็งแกร่ง F 2, MNO 2, KMNO 4, KCLO 3, K 2 CR 2 O 7 Anion CL - ออกซิไดซ์เป็นฮาโลเจนฟรี:
2CL - - 2E - \u003d CL 2 0
สมการปฏิกิริยาเห็น "การรับคลอรีน" ความสำคัญเป็นพิเศษคือ OSR ระหว่างกรดไฮโดรคลอริกและไนตริก:

ปฏิกิริยากับสารอินทรีย์
การโต้ตอบ:
a) กับเอมีน (เป็นบริเวณอินทรีย์)
R-NH 2 + HCL → + CL -
b) กับกรดอะมิโน (เช่นเดียวกับการเชื่อมต่ออำเภอละแวก)

ออกไซด์และ oxocuslots คลอรีน
กรดออกไซด์

กรด

sololi
คุณสมบัติทางเคมี
1. คลอรีน oxocosls ทั้งหมดและเกลือของพวกเขาเป็นตัวแทนออกซิไดซ์ที่แรง
2. สารประกอบเกือบทั้งหมดในระหว่างการทำความร้อนจะย่อยสลายเนื่องจากการเกิดออกซิเดชันออกซิเดชันระหว่างเกิดหรือไม่สมส่วน

ผงฟอกสี
มะนาวคลอรีน (Bellen) - ส่วนผสมของ hypochlorite และแคลเซียมคลอไรด์มีผลไวท์เทนนิ่งและฆ่าเชื้อโรค บางครั้งถือว่าเป็นตัวอย่างของเกลือผสมซึ่งในองค์ประกอบของมันในเวลาเดียวกันประจุของกรดสองตัว:

น้ำ zhawl
สารละลายที่เป็นน้ำของคลอไรด์โพแทสเซียม KCL + KCLO + H 2 O
ลักษณะขององค์ประกอบของกลุ่ม VII ของกลุ่มย่อยหลักบนตัวอย่างของคลอรีน
ลักษณะทั่วไปของกลุ่มย่อย
ตารางที่ 1. NOMECKLATURE องค์ประกอบของ Subgroup VIIA
องค์ประกอบ P, ทั่วไป, ไม่ใช่โลหะ (ASTAT - Semimetal), Halogens
แผนภูมิองค์ประกอบอิเล็กทรอนิกส์ HAL (HAL ≠ F):
สำหรับองค์ประกอบของ Subgroup VIIA นั้นโดดเด่นด้วยความจุต่อไปนี้:
ตารางที่ 2. Valence
3. สำหรับองค์ประกอบของ Subgroup VIIA องศาออกซิเดชั่นต่อไปนี้เป็นลักษณะ:
ตารางที่ 3. องค์ประกอบออกซิเดชันขององค์ประกอบ
ลักษณะขององค์ประกอบทางเคมี
คลอรีน - องค์ประกอบ vii กลุ่ม หมายเลขซีเรียล 17
น้ำหนักปรมาณูญาติ: 35,4527 a e. m. (g / mol)
 จำนวนโปรตอนนิวตรอนอิเล็กตรอน: 17,18,17
จำนวนโปรตอนนิวตรอนอิเล็กตรอน: 17,18,17
โครงสร้างอะตอม:
![]()
สูตรอิเล็กทรอนิกส์:
องศาทั่วไปของการเกิดออกซิเดชัน: -1, 0, +1, +3, +4, +5, +7
พลังงานไอออนไนซ์: 1254.9 (13.01) KJ / MOL (EV)
Affinity อิเล็กตรอน: 349 (KJ / MOL)
ไฟฟ้าโดย Paulonga: 3.20
ลักษณะของสารง่าย
ประเภทการสื่อสาร: พันธสัญญาที่ไม่ใช่ขั้วโลก
โมเลกุลคู่
ไอโซโทป: 35 cl (75.78%) และ 37 cl (24.22%)
ประเภทของ Crystal Lattice: โมเลกุล
พารามิเตอร์ทางอุณหพลศาสตร์
ตารางที่ 4.
สมบัติทางกายภาพ
ตารางที่ 5
คุณสมบัติทางเคมี
สารละลายน้ำของคลอรีนส่วนใหญ่ถอดออกได้ ("น้ำคลอรีน")
1 ขั้นตอน: CL 2 + H 2 O \u003d HCL + HOCL
2 ขั้นตอน: hocl \u003d hcl + [o] - ออกซิเจนอะตอม
ความจุออกซิเดชั่นในกลุ่มย่อยลดลงจากฟลูออไรด์เป็นไอโอดีน \u003d ˃
คลอรีนออกซิไดเซอร์ที่แข็งแกร่ง:
1. ปฏิสัมพันธ์กับสารง่าย ๆ
a) ด้วยไฮโดรเจน:
CL 2 + H 2 \u003d 2HCL
b) กับโลหะ:
CL 2 + 2NA \u003d 2NACL
3CL 2 + 2FE \u003d 2Fecl 3
c) ด้วยโลหะที่ไม่ใช่โลหะที่ไม่ใช่โลหะน้อยกว่า:
3CL 2 + 2P \u003d 2pcl 3
CL 2 + S \u003d SCL 2
ด้วยออกซิเจนคาร์บอนและไนโตรเจนคลอรีนโดยตรง ไม่ตอบสนอง!
2. ปฏิสัมพันธ์กับสารที่ซับซ้อน
a) กับน้ำ: ดูด้านบน
b) ด้วยกรด: ไม่ตอบสนอง!
c) ด้วยโซลูชั่น Alkalis:
ในเย็น: CL 2 +2 Naoh \u003d NACL + NACLO + H 2 O
เมื่อได้รับความร้อน: 3CL 2 + 6 KOH \u003d 5KCL + KCLO 3 + 3H 2 O
e) ด้วยสารอินทรีย์มากมาย:
CL 2 + CH 4 \u003d CH 3 CL + HCL
c 6 h 6 + cl 2 \u003d c 6 h 5 cl + hcl
สารประกอบที่สำคัญที่สุดคลอรีน
 คลอไรด์ไฮโดรเจนคลอไรด์(HCL) - ไม่มีสีก๊าซคงที่ด้วยความร้อน (ภายใต้สภาวะปกติ) ด้วยกลิ่นที่คมชัดการสูบบุหรี่ในอากาศเปียกก็ละลายได้ง่ายในน้ำ (มากถึง 500 ปริมาณก๊าซต่อปริมาณน้ำ) ด้วยการก่อตัวของกรดคลอไรด์ (ไฮโดรคลอริก) ที่ -114.22 ° C hcl เข้าไปในสถานะที่ยากลำบาก ในสถานะทึบคลอไรด์อยู่ในรูปแบบของการปรับเปลี่ยนผลึกสองชนิด: ขนมชำมีเสถียรภาพด้านล่างและลูกบาศก์
คลอไรด์ไฮโดรเจนคลอไรด์(HCL) - ไม่มีสีก๊าซคงที่ด้วยความร้อน (ภายใต้สภาวะปกติ) ด้วยกลิ่นที่คมชัดการสูบบุหรี่ในอากาศเปียกก็ละลายได้ง่ายในน้ำ (มากถึง 500 ปริมาณก๊าซต่อปริมาณน้ำ) ด้วยการก่อตัวของกรดคลอไรด์ (ไฮโดรคลอริก) ที่ -114.22 ° C hcl เข้าไปในสถานะที่ยากลำบาก ในสถานะทึบคลอไรด์อยู่ในรูปแบบของการปรับเปลี่ยนผลึกสองชนิด: ขนมชำมีเสถียรภาพด้านล่างและลูกบาศก์
สารละลายน้ำของไฮโดรเจนคลอไรด์เรียกว่ากรดไฮโดรคลอริก เมื่อละลายในน้ำกระบวนการต่อไปนี้ดำเนินการต่อไป:
hcl r + h 2 o w \u003d h 3 o + f + cl -
กระบวนการสลายตัวมีความคึกคักสูง ด้วยน้ำ HCl รูปแบบผสม Azeotropic มันเป็นกรดโมโนโซคอนที่แข็งแกร่ง มีปฏิสัมพันธ์กับโลหะทั้งหมดที่ยืนอยู่ในแรงดันไฟฟ้าจำนวนหนึ่งไปทางด้านซ้ายของไฮโดรเจนด้วยการออกไซด์พื้นฐานและอะแลริค์ฐานและเกลือการสร้างเกลือ - chlorida:
MG + 2 HCL → MGCL 2 + H 2
FEO + 2 HCL → FECL 2 + H 2 O
ภายใต้การกระทำของสารออกซิไดซ์ที่แรงหรือด้วยกระแสไฟฟ้าการลดคุณสมบัติของคลอไรด์:
MNO 2 + 4 HCL → MNCL 2 + CL 2 + 2 H 2 O
เมื่อความร้อนคลอไรด์ออกซิไดซ์ด้วยออกซิเจน (ตัวเร่งปฏิกิริยา - COCL 2 คลอไรด์ (II) 2):
4 HCL + O 2 → 2 H 2 O +2 CL 2
อย่างไรก็ตามกรดไฮโดรคลอริกเข้มข้นมีการทำปฏิกิริยากับทองแดงที่ซับซ้อนของทองแดง Monovalent นั้นเกิดขึ้น:
2 Cu + 4 HCL → 2 H + H 2
ส่วนผสมของ 3 ชิ้นส่วนเล่มของไฮโดรคลอริกเข้มข้นและเศษส่วน 1 ปริมาณของกรดไนตริกเข้มข้นเรียกว่า "วอดก้าซาร์" Royal Vodka สามารถละลายได้แม้แต่ทองคำและแพลตตินัม กิจกรรมออกซิเดชั่นสูงของ Royal Vodka เกิดจากการปรากฏตัวของไนโตรเจนและคลอรีนคลอไรด์ในนั้นซึ่งอยู่ในสมดุลกับสารที่มา:
4 ชม. 3 O + + 3 CL - + NO 3 - \u003d NOCL + CL 2 + 6 H 2 O
เนื่องจากความเข้มข้นสูงของคลอไรด์ไอออนในการแก้ปัญหาโลหะมีความเกี่ยวข้องกับคลอไรด์คอมเพล็กซ์ซึ่งก่อให้เกิดการละลายของมัน:
3 PT + 4 HNO 3 + 18 HCL → 3 H 2 + 4 NO + 8 H 2 O
สำหรับ Chloroodor ปฏิกิริยาต่อหลายความสัมพันธ์ (การเชื่อมต่ออิเล็กโทรฟิลี) เป็นลักษณะ:
R-CH \u003d CH 2 + HCL → R-CHCL-CH 3
R-C≡ch + 2 HCL → R-CCL 2 -Ch 3
คลอรีนออกไซด์ - สารประกอบทางเคมีอนินทรีย์ของคลอรีนและออกซิเจนสูตรทั่วไป: CL X O.
คลอรีนฟอร์มออกไซด์ต่อไปนี้: CL 2 O, CL 2 O 3, Clo 2, CL 2 O 4, CL 2 O 6, CL 2 O 7 นอกจากนี้ยังมีคลอรีนคลอรีนที่มีอายุสั้นของคลอรีนคลอรีนและคลอรีนคลอรีน Tetraoxide Clo 4 Radical
ด้านล่างในตารางแสดงคุณสมบัติของคลอรีนออกไซด์ที่มีเสถียรภาพ:
ตารางที่ 6.
| อสังหาริมทรัพย์ | CL 2 O. | Clo 2 | cloclo 3. | CL 2 O 6 (G) ↔2CLO 3 (G) | CL 2 O 7 |
| สีและสภาพที่มีเตียง อุณหภูมิ | ก๊าซสีเทาน้ำตาล | ก๊าซสีเทาเขียว | ของเหลวสีเหลืองอ่อน | ของเหลวสีแดงเข้ม | ของเหลวไม่มีสี |
| ระดับของคลอรีนออกซิเดชั่น | (+1) | (+4) | (+1), (+7) | (+6) | (+7) |
| T. PL., ° C | −120,6 | −59 | −117 | 3,5 | −91,5 |
| T. Kip., ° C | 2,0 | 44,5 | |||
| d. (f, 0 ° C), g * cm -3 | - | 1,64 | 1,806 | - | 2,02 |
| δh° ARG (GAZ, 298 K), KJ * MOL -1 | 80,3 | 102,6 | ~180 | (155) | |
| δG° CPA (GAZ, 298 K), KJ * MOL -1 | 97,9 | 120,6 | - | - | - |
| S ° ORG (GAZ, 298 K), J * K -1 * MOL -1 | 265,9 | 256,7 | 327,2 | - | - |
| โมเมนต์ไดโพลμ, d | 0.78 ± 0.08 | 1.78 ± 0.01 | - | - | 0.72 ± 0.02 |
 คลอรีนออกไซด์ (i), Dichlor's Oxide, Chlorothic Acid Anhydride - สารประกอบคลอรีนในระดับออกซิเดชั่นด้วยออกซิเจน
คลอรีนออกไซด์ (i), Dichlor's Oxide, Chlorothic Acid Anhydride - สารประกอบคลอรีนในระดับออกซิเดชั่นด้วยออกซิเจน
ภายใต้สภาวะปกติมันเป็นก๊าซสีน้ำตาลเหลืองที่มีกลิ่นลักษณะคล้ายกับกลิ่นคลอรีน ที่อุณหภูมิต่ำกว่า 2 ° C - ของเหลวสีแดงทอง พิษ: การโจมตีทางเดินหายใจ สลายตัวช้าตามธรรมชาติ:
ที่ความเข้มข้นขนาดใหญ่จะระเบิด ความหนาแน่นภายใต้สภาวะปกติ 3.22 กก. / m³ ละลายในคาร์บอนสี่คลอไรด์ ละลายได้ดีในน้ำด้วยการก่อตัวของกรด chlornotic ที่อ่อนแอ:
ตอบสนองอย่างรวดเร็วด้วย Alkalis:
CL 2 O + 2NAOH (RSC) \u003d 2NACLO + H 2 O
คลอรีนไดออกไซด์ - กรดออกไซด์ เมื่อละลายในน้ำคลอไรด์กรดคลอรีน (ปฏิกิริยาสัดส่วน) เกิดขึ้น โซลูชันเจือจางมีความต้านทานในที่มืดแสงสลายช้าๆ:
 คลอรีนไดออกไซด์ - คลอรีนออกไซด์ ( IV), คลอรีนและสารประกอบออกซิเจนสูตร: Clo 2
คลอรีนไดออกไซด์ - คลอรีนออกไซด์ ( IV), คลอรีนและสารประกอบออกซิเจนสูตร: Clo 2
ภายใต้สภาวะปกติ Clo 2 เป็นก๊าซก๊าซสีแดงสีเหลืองที่มีกลิ่นหอม ที่อุณหภูมิต่ำกว่า 10 ° C Clo 2 เป็นของเหลวสีน้ำตาลแดง ทนต่อความทนทานระเบิดไปที่แสงในระหว่างการสัมผัสกับสารออกซิไดซ์และเมื่อได้รับความร้อน ละลายได้ดีในน้ำ เนื่องจากการระเบิดของคลอรีนไดออกไซด์จึงเป็นไปไม่ได้ที่จะเก็บในรูปแบบของของเหลว
กรดออกไซด์ เมื่อละลายในน้ำคลอไรด์กรดคลอรีน (ปฏิกิริยาสัดส่วน) เกิดขึ้น โซลูชันเจือจางมีความต้านทานในที่มืดแสงสลายช้าๆ:
กรดคลอไรด์ที่เกิดขึ้นนั้นไม่เสถียรและย่อยสลาย:
แสดงคุณสมบัติ Redox
2CLO 2 + 5H 2 SO 4 (RSC) + 10FESO 4 \u003d 5FE 2 (4) 3 + 2HCL + 4H 2 O
Clo 2 + 2Naoh ร้อน \u003d Naclo 2 + Naclo 3 + H 2 O
Clo 2 + O 3 \u003d Clo 3 + O 2
Clo 2 ทำปฏิกิริยากับสารประกอบอินทรีย์มากมายและดำเนินการตัวแทนออกซิไดซ์ของแรงกลาง
 กรด Chlornanic - HCLO กรด Monosocond ที่อ่อนแอมากซึ่งคลอรีนมีระดับของการเกิดออกซิเดชัน +1 มีวิธีแก้ปัญหาเท่านั้น
กรด Chlornanic - HCLO กรด Monosocond ที่อ่อนแอมากซึ่งคลอรีนมีระดับของการเกิดออกซิเดชัน +1 มีวิธีแก้ปัญหาเท่านั้น
ในการแก้ปัญหาน้ำกรด Chlorothic บางส่วนจะสลายตัวบนโปรตอนและไส้ศ์ไอออนคลอส -:
ไม่เสถียร กรด Chlornanotic และเกลือ - hypochlorites - ออกซิไดซ์ที่แข็งแกร่ง ทำปฏิกิริยากับกรดไฮโดรคลอริก HCL ขึ้นรูปคลอรีนโมเลกุล:
hclo + naoh (rsc) \u003d naclo + h 2 o 
กรดสีน้ำตาล - HCLO 2, กรดแกนเดียวของพลังงานปานกลาง
กรดคลอไรด์ NCLO 2 ในรูปแบบอิสระของไม่เสถียรแม้ในสารละลายน้ำที่เจือจางมันสลายตัวได้อย่างรวดเร็ว:
ทำให้เป็นกลางโดย Alkalis
HCLO 2 + Naoh (RSC Hot.) \u003d Naclo 2 + H 2 O
Anhydride ของกรดนี้ไม่เป็นที่รู้จัก
โซลูชันกรดได้รับจากเกลือของมัน - คลอไรต์เป็นผลมาจากการโต้ตอบของ Clo 2 ด้วยระดับเสียง:
ล้างคุณสมบัติ Redox
5HCLO 2 + 3H 2 SO 4 (RSC) + 2KMNO 4 \u003d 5HCLO 3 + 2MNSO 4 + K 2 ดังนั้น 4 + 3h 2 o
 กรดคลอเรค - HCLO 3 กรด Monosocond ที่แข็งแกร่งซึ่งคลอรีนมีระดับของการเกิดออกซิเดชัน +5 ไม่ได้รับแบบฟอร์มฟรี ในการแก้ปัญหาน้ำที่ความเข้มข้นต่ำกว่า 30% ในเย็นค่อนข้างมั่นคง ในการแก้ปัญหาที่เข้มข้นมากขึ้นสลายตัว:
กรดคลอเรค - HCLO 3 กรด Monosocond ที่แข็งแกร่งซึ่งคลอรีนมีระดับของการเกิดออกซิเดชัน +5 ไม่ได้รับแบบฟอร์มฟรี ในการแก้ปัญหาน้ำที่ความเข้มข้นต่ำกว่า 30% ในเย็นค่อนข้างมั่นคง ในการแก้ปัญหาที่เข้มข้นมากขึ้นสลายตัว:
กรด Chlornic - ออกซิไดเซอร์ที่แรง ความจุออกซิเดชั่นเพิ่มขึ้นด้วยความเข้มข้นที่เพิ่มขึ้นและอุณหภูมิ HCLO 3 ได้รับการคืนค่ากรดไฮโดรคลอริกได้อย่างง่ายดาย:
HCLO 3 + 5HCL (CONC.) \u003d 3CL 2 + 3H 2 O
HCLO 3 + Naoh (SPZ.) \u003d Naclo 3 + H 2 O
เมื่อส่วนผสมของ 2 และอากาศถูกส่งผ่านทางออกที่เป็นกรดอย่างมากคลอรีนไดออกไซด์จะถูกสร้างขึ้น:
ใน 40% Chlorinic Acid Flames เช่นกระดาษกรอง
8. การค้นหาในธรรมชาติ:
ในคลอรีนเปลือกโลกของโลกเป็นฮาโลเจนที่พบมากที่สุด เนื่องจากคลอรีนมีความกระตือรือร้นมากในธรรมชาติพบได้เฉพาะในรูปแบบของสารประกอบในแร่ธาตุ
ตารางที่ 7. การค้นหาในธรรมชาติ
ตารางที่ 7. แร่รูปแบบ
ปริมาณคลอรีนที่ใหญ่ที่สุดมีอยู่ในองค์ประกอบของเกลือของทะเลและมหาสมุทร
การได้รับ
วิธีการทางเคมีสำหรับการผลิตคลอรีนไม่มีประสิทธิภาพและค่าใช้จ่าย จนถึงปัจจุบันพวกเขาส่วนใหญ่มีความสำคัญทางประวัติศาสตร์ สามารถรับได้ในปฏิสัมพันธ์ของ Potassium Permanganate กับกรดไฮโดรคลอริก:
วิธีการ Sheel
ในขั้นต้นวิธีการอุตสาหกรรมสำหรับการรับคลอรีนขึ้นอยู่กับวิธีการของเชลเล่นั่นคือปฏิกิริยา Pyro-Hydrochloride กับกรดไฮโดรคลอริก:
วิธี DICON
วิธีการผลิตคลอรีนด้วยการเกิดปฏิกิริยาออกซิเดชั่นของ Chloroodore Air Oxygen
วิธีการทางเคมีไฟฟ้า
วันนี้คลอรีนในระดับอุตสาหกรรมได้มาพร้อมกับโซเดียมไฮดรอกไซด์และไฮโดรเจนโดยกระแสไฟฟ้าของสารละลายเกลือโซเดียมกระบวนการหลักที่สามารถส่งโดยสูตรทั้งหมด:
การประยุกต์ใช้
·โปรไฟล์หน้าต่างทำจากโพลิเมอร์ที่มีคลอรีน
·องค์ประกอบหลักของการฟอกสีคือน้ำ Labarracova (โซเดียมไฮโปคลอไรต์)
·ในการผลิตโพลีไวนิลคลอไรด์พลาสติกยางสังเคราะห์
·การผลิตของ chlororganic ส่วนสำคัญของคลอรีนที่ผลิตใช้กับเครื่องมือป้องกันพืช หนึ่งในยาฆ่าแมลงที่สำคัญที่สุดคือ Hexachlorcyclohexane (มักเรียกว่า Hexachlororan)
·ใช้เป็นสารพิษการต่อสู้เช่นเดียวกับการผลิตสารพิษการต่อสู้อื่น ๆ : iPrit, Phosgene
·เพื่อฆ่าเชื้อน้ำ - "คลอรีน"
·อุตสาหกรรมอาหารลงทะเบียนเป็นอาหารเสริม E925
·ในการผลิตสารเคมีของกรดไฮโดรคลอริก, คลอรีนมะนาว, เกลือ Bertolen, คลอไรด์โลหะ, สารพิษ, ยา, ปุ๋ย
·ในโลหะผสมสำหรับการผลิตโลหะบริสุทธิ์: ไทเทเนียม, ดีบุก, แทนทาลัม, ไนโอเบียม
·เป็นตัวบ่งชี้ของ Neutrins พลังงานแสงอาทิตย์ในเครื่องตรวจจับคลอรีน - อาร์กอน
หลายประเทศที่พัฒนาแล้วพยายาม จำกัด การใช้คลอรีนในชีวิตประจำวันรวมถึงเพราะการเผาไหม้ของขยะที่มีสารคลอรีนจำนวนมากของไดออกซินที่เกิดขึ้น
คลอรีนอาจได้รับนักเล่นแร่แปรธาตุมากขึ้น แต่การค้นพบของเขาและการศึกษาครั้งแรกนั้นเชื่อมโยงกับชื่อของนักเคมีชาวสวีเดนที่มีชื่อเสียง Karl Wilhelm Shelele เชลเล่เปิดห้าองค์ประกอบทางเคมี - แบเรียมและแมงกานีส (พร้อมกับ Yuhan Gan), โมลิบดีนัม, ทังสเตน, คลอรีนและโดยไม่คำนึงถึงนักเคมีคนอื่น ๆ (แม้ว่าในภายหลัง) - อีกสามคน: ออกซิเจนไฮโดรเจนและไนโตรเจน ความสำเร็จนี้ไม่สามารถทำซ้ำนักเคมีได้ ในขณะเดียวกันเชลเล่ซึ่งได้รับการเลือกตั้งจากสมาชิกของ Swedish Royal Academy of Sciences เป็นเภสัชกรที่เรียบง่ายใน Cheping แม้ว่าเขาจะได้รับตำแหน่งที่มีเกียรติและมีเกียรติมากขึ้น Friedrich II Great ตัวเองกษัตริย์ปรัสเซียนเสนอให้เขาทำโพสต์ของศาสตราจารย์วิชาเคมีของมหาวิทยาลัยเบอร์ลิน ปฏิเสธข้อเสนอล่อลวงดังกล่าว Syel กล่าวว่า: "ฉันกินไม่ได้มากกว่าที่ฉันต้องการและสิ่งที่ฉันได้รับที่นี่ใน Cheping ฉันมีอาหารเพียงพอ"
สารประกอบคลอรีนจำนวนมากเป็นที่รู้จักกันมานานก่อนที่เชลเล่ องค์ประกอบนี้เป็นส่วนหนึ่งของเกลือจำนวนมากรวมถึงเกลือที่มีชื่อเสียงที่สุด - โต๊ะ ในปี ค.ศ. 1774 เชลลีไฮไลต์คลอรีนในรูปแบบอิสระความร้อนน้ำแร่สีดำที่มีกรดไฮโดรคลอริกเข้มข้น: MNO 2 + 4HCL ® CL 2 + MNCL 2 + 2H 2 O.
ในขั้นต้นนักเคมีถือว่าคลอรีนไม่ได้เป็นองค์ประกอบ แต่เป็นสารเคมีขององค์ประกอบที่ไม่รู้จักของ Muria (จากละติน Muria - น้ำเกลือ) กับออกซิเจน เชื่อกันว่ามีกรดไฮโดรคลอริก (เรียกว่าภาพจิตรกรรมฝาผนัง) มีออกซิเจนที่ถูกผูกมัดทางเคมี โดยเฉพาะอย่างยิ่ง "พยาน" โดยเฉพาะอย่างยิ่งข้อเท็จจริงดังกล่าว: เมื่อการแก้ปัญหาของคลอรีนกำลังยืนออกซิเจนได้รับการปล่อยตัวจากมันและกรดไฮโดรคลอริกยังคงอยู่ในการแก้ปัญหา อย่างไรก็ตามความพยายามมากมายที่จะ "ฉีกออก" ออกซิเจนจากคลอรีนไม่ได้นำไปสู่อะไรเลย ดังนั้นไม่มีใครสามารถรับเงินคาร์บอนไดออกไซด์คลอรีนให้ความร้อนกับถ่านหิน (ซึ่งอุณหภูมิสูง "นำออกไป" ออกซิเจนจากสารประกอบจำนวนมากที่มี) อันเป็นผลมาจากการทดลองดังกล่าวดำเนินการโดย Gemphri Davy, Joseph Louis เกย์-Louusak และ Louis Jacques Tenar มันชัดเจนว่าคลอรีนไม่มีออกซิเจนและเป็นสารง่าย ๆ นอกจากนี้การทดลองนำการทดลองของเกย์ -loussak ซึ่งวิเคราะห์อัตราส่วนเชิงปริมาณของก๊าซในปฏิกิริยาคลอรีนกับไฮโดรเจน
ในปี 1811 Davy เสนอชื่อ "Chlorin" สำหรับองค์ประกอบใหม่ - จากภาษากรีก "Chloros" เป็นสีเหลืองสีเขียว มันเป็นสีที่มีคลอรีน รากเดียวกันอยู่ในคำว่า "คลอโรฟิลล์" (จากกรีก "คลอโร" และ "ฟิลลอน" - ใบไม้) หนึ่งปีต่อมาเกย์ Lussak "ตัด" ชื่อเป็นคลอรีน แต่จนถึงตอนนี้ชาวอังกฤษ (และชาวอเมริกัน) เรียกว่าองค์ประกอบนี้ "คลอรีน" (คลอรีน) ในขณะที่ฝรั่งเศสเป็นคลอรีน (ชลอร์) ยอมรับชื่อที่ย่อและชาวเยอรมัน - "ผู้ร่างกฎหมาย" ของเคมีตลอดเกือบจะเพียง 19 V (คลอรีนเยอรมัน - คลอร์) ในปี 1811 นักฟิสิกส์ชาวเยอรมัน Johann Schweiher แนะนำชื่อ "ฮาโลเจน" สำหรับคลอรีน (จากกรีก "hals" - เกลือและ "Gennao" - ให้กำเนิด) ต่อจากนั้นคำนี้ที่ยึดมั่นไม่เพียง แต่สำหรับคลอรีน แต่ยังสำหรับ analogues ทั้งหมดตามกลุ่มที่เจ็ด - ฟลูออรีนโบรมีนไอโอดีนสตัท
การสาธิตการเผาไหม้ไฮโดรเจนในบรรยากาศของคลอรีนเป็นที่น่าสนใจ: บางครั้งผลข้างเคียงที่ผิดปกติเกิดขึ้นระหว่างประสบการณ์: ได้ยินเสียงพึมพำ บ่อยครั้งที่เปลวไฟกำลังคึกคักเมื่อท่อบาง ๆ ถูกป้อนโดยไฮโดรเจนจะลดลงในภาชนะของรูปร่างกรวยที่เต็มไปด้วยคลอโร; เช่นเดียวกับที่เป็นจริงสำหรับขวดทรงกลม แต่ในกระบอกสูบเปลวไฟมักจะไม่คึกคัก ปรากฏการณ์นี้เรียกว่า "เปลวไฟหว่าน"
ในสารละลายน้ำคลอรีนบางส่วนและค่อนข้างช้าทำปฏิกิริยากับน้ำ ที่ 25 ° C ดุลยภาพ: CL 2 + H 2 O HCLO + HCL ติดตั้งเป็นเวลาสองวัน กรดคลอเรสในการสลายตัวของแสง: HCLO ® HCL + O. มันเป็นออกซิเจนอะตอมที่มีคุณสมบัติไวท์เทนนิ่ง (คลอรีนแห้งอย่างแน่นอนไม่มีความสามารถดังกล่าว)
คลอรีนในสารประกอบสามารถแสดงการออกซิเดชั่นทั้งหมด - จาก -1 ถึง +7 ด้วยการออกซิเจนคลอรีนเป็นชุดของออกไซด์พวกเขาทั้งหมดอยู่ในรูปแบบที่บริสุทธิ์นั้นไม่เสถียรและระเบิด: CL 2 O เป็นก๊าซสีเหลืองสีส้มก๊าซ Clo 2 - สีเหลือง (ต่ำกว่า 9.7 ° C - ของเหลวสีสดใส), Chlorate Chlorine CL 2 o 4 (clo -clo 3, ของเหลวสีเหลืองอ่อน), CL 2 O 6 (O 2 cl-o-clo 3, ของเหลวสีแดงสดใส), CL 2 O 7 - ของเหลวที่ไม่มีสีระเบิดมาก ที่อุณหภูมิต่ำ CL 2 O 3 และ CLO 3 ออกไซด์ได้รับ Clo 2 ออกไซด์ผลิตในระดับอุตสาหกรรมและใช้แทนคลอรีนสำหรับเซลลูโลสฟอกสีและการฆ่าเชื้อโรคของน้ำดื่มและน้ำเสีย ด้วย halogens อื่น ๆ คลอรีนเป็นจำนวนมากที่เรียกว่าสารประกอบ intergenogenic ตัวอย่างเช่น CLF, CLF 3, CLF 5, BRCL, ICL, ICL 3
คลอรีนและสารประกอบที่มีการออกซิเดชันในระดับบวกเป็นสารออกซิไดซ์ที่แรง ในปี 1822 นักเคมีชาวเยอรมัน Leopold Gmelin โดยออกซิไดซ์คลอรีนจากเกลือเลือดสีเหลือง: 2K 4 + CL 2 ® K 3 + 2KCL คลอรีนออกซิไดซ์โบรไมด์และคลอไรด์ได้อย่างง่ายดายด้วยรูปแบบฟรีของโบรมีนและไอโอดีน
คลอรีนในองศาออกซิเดชันที่แตกต่างกันเป็นแถวของกรด: HCl - คลอไรด์ (เกลือ, เกลือ - คลอไรด์), HCLO - Chlosiness (Salts - Hypochlorites), Hclo 2 - คลอไรด์ (Salts - Chlorite), Hclo 3 - Chloroant (Salts - คลอเรต) , HCLO 4 - คลอรีน (เกลือ - Perchlorates) ในรูปแบบบริสุทธิ์ของกรดออกซิเจนเท่านั้นคลอรีนเท่านั้นที่มีเสถียรภาพ จากเกลือของกรดออกซิเจนแอปพลิเคชันที่ใช้งานได้จริงมี hypochlorites, โซเดียมคลอไรต์ Naclo 2 - สำหรับเนื้อเยื่อไวท์เทนนิ่งสำหรับการผลิตแหล่งพลิกไฟขนาดกะทัดรัดของออกซิเจน ("เทียนออกซิเจน"), โพแทสเซียมคลอเรต (เกลือ Bertolet) แคลเซียมและแมกนีเซียม (เพื่อต่อสู้กับการเกษตร ศัตรูพืชเป็นส่วนประกอบขององค์ประกอบของดาวพลุและวัตถุระเบิดในการผลิตการแข่งขัน), perchlorates - ส่วนประกอบของวัตถุระเบิดและองค์ประกอบของพลุ; แอมโมเนียม Perchlorate เป็นองค์ประกอบของเชื้อเพลิงจรวดที่เป็นของแข็ง
คลอรีนทำปฏิกิริยากับสารอินทรีย์มากมาย มันเข้าร่วมสารประกอบที่ไม่อิ่มตัวอย่างรวดเร็วด้วยพันธะคาร์บอนสองชั้นและสามคาร์บอน (ปฏิกิริยากับอะเซทิลีนเกิดขึ้นกับการระเบิด) และในแสงสว่าง - และเบนซีน ภายใต้เงื่อนไขบางประการคลอรีนสามารถแทนที่อะตอมไฮโดรเจนในสารประกอบอินทรีย์: R-H + CL 2 ® RCL + HCL ปฏิกิริยานี้มีบทบาทสำคัญในประวัติศาสตร์ของเคมีอินทรีย์ ในยุค 1840 นักเคมีชาวฝรั่งเศส Jean Batiste Duma ค้นพบว่าภายใต้การกระทำของคลอรีนในกรดอะซิติกที่น่าตื่นตาตื่นใจมีปฏิกิริยา
CH 3 SOAM + CL 2 ® CH 2 CLCOOH + HCL ด้วยคลอรีนส่วนเกินกรด Trichloroacetic SL 3 Coxy จะเกิดขึ้น อย่างไรก็ตามนักเคมีหลายคนมีปฏิกิริยาตอบสนองใน Duma อย่างไม่น่าเชื่อ แน่นอนตามที่ยอมรับโดยทั่วไปทฤษฎีของ Bercelius อะตอมไฮโดรเจนที่มีประจุบวกไม่สามารถแทนที่ด้วยอะตอมคลอรีนที่มีประจุลบ ความคิดเห็นนี้ได้รับการปฏิบัติต่อนักเคมีที่โดดเด่นในเวลานั้นในช่วงเวลานั้นคือ Friedrich Völer, Yustus libih และแน่นอน Bercelius เอง
เพื่อให้ความสนุกของ Dumas Vyler ทำให้เพื่อนของเขา Libiha บทความในนามของ Schwindler (Schwindler - ในผู้หลอกลวงเยอรมัน) เกี่ยวกับแอปพลิเคชันที่ประสบความสำเร็จใหม่ที่ถูกกล่าวหาว่าเปิดปฏิกิริยา Duma ในบทความ Vyler ที่มีการวางกับดักที่ชัดเจนเขียนเกี่ยวกับวิธีใน Acetic Acid Manganese MN (CH 3 COO) 2 จัดการองค์ประกอบทั้งหมดตามความสามารถของพวกเขาแทนที่ด้วยคลอรีนส่งผลให้เกิดสารผลึกสีเหลืองที่ประกอบด้วยคลอรีนเพียงอย่างเดียว มีการกล่าวกันว่าในอังกฤษอะตอมทั้งหมดบนอะตอมคลอรีนในสารอินทรีย์ในสารประกอบอินทรีย์เนื้อเยื่อธรรมดากลายเป็นคลอรีนและในขณะที่สิ่งต่าง ๆ ยังคงรูปลักษณ์ของพวกเขา เชิงอรรถระบุว่าร้านขายเสื้อโค้ทในลอนดอนมีการซื้อขายด้วยวัสดุที่ประกอบด้วยคลอรีนหนึ่งตัวเนื่องจากวัสดุนี้ดีมากสำหรับหมวกกลางคืนและคุณลักษณะที่อบอุ่น
ปฏิกิริยาคลอรีนกับสารอินทรีย์นำไปสู่การก่อตัวของชุดผลิตภัณฑ์ chlororganic ที่ใช้กันอย่างแพร่หลายของ methylene คลอไรด์ ch 2 cl 2, คลอโรฟอร์ม Chcl 3, CCl สี่คลอไรด์คลอไรด์, Tetrachlorethylene CCL 2, Tetrachlorethylene C 2 cl 4. ในการปรากฏตัวของความชื้นคลอรีนพัดใบสีเขียวของพืชสีย้อมหลายสี สิ่งนี้ถูกใช้ในศตวรรษที่ XVIII สำหรับผ้าไวท์เทนนิ่ง
คลอรีนเป็นพิษเป็นพิษ
คลอรีนเชลเลนฉลองกลิ่นที่คมชัดมากของเขาหายใจลำบากและไอ หลังจากนั้นบุคคลนั้นรู้สึกถึงกลิ่นคลอรีนแม้ว่าในหนึ่งลิตรของอากาศมีก๊าซเพียง 0.005 มก. ของก๊าซนี้และในเวลาเดียวกันก็มีผลกระทบที่ระคายเคืองต่อระบบทางเดินหายใจทำลายเซลล์ของเยื่อเมือกของเยื่อเมือกของระบบทางเดินหายใจ ระบบทางเดินอาหารและปอด ความเข้มข้นของ 0.012 mg / l สวมใส่ด้วยความยากลำบาก หากความเข้มข้นของคลอรีนเกิน 0.1 มก. / ล. มันจะกลายเป็นอันตรายถึงชีวิต: การหายใจมีราคาแพงกลายเป็นอาการกระตุกแล้วทุกอย่างหายากมากขึ้นและหลังจาก 5-25 นาทีหายใจ สูงสุดที่อนุญาตในอากาศของผู้ประกอบการอุตสาหกรรมคือความเข้มข้นของ 0.001 mg / l และในอากาศของพื้นที่อยู่อาศัย - 0.00003 mg / l
Petersburg Academician Tovi Egorovich Lovitz ทำซ้ำในปี ค.ศ. 1790 ประสบการณ์ของเชลเล่เปิดตัวคลอรีนจำนวนมากในอากาศ ตรวจสอบมันเขาสูญเสียสติและตกต่ำแล้วเป็นเวลาแปดวันได้รับความเจ็บปวดจากความเจ็บปวดที่หน้าอกของเขา โชคดีที่เขาฟื้นตัว ฉันเกือบเสียชีวิตโดยมีคลอรีนและนักเคมีชาวอังกฤษที่มีชื่อเสียงเดวี่ การทดลองแม้จะมีคลอรีนจำนวนเล็กน้อยเป็นอันตรายเนื่องจากอาจทำให้ปอดเสียหายอย่างรุนแรง มีการกล่าวกันว่านักเคมีชาวเยอรมัน Eaga Vieberg หนึ่งในการบรรยายของเขาเกี่ยวกับคลอรีนเริ่มต้นด้วย: "คลอรีนเป็นก๊าซพิษ ถ้าฉันเทออกในระหว่างการสาธิตครั้งต่อไปพาฉันไปโปรดไปที่อากาศบริสุทธิ์ แต่การบรรยายในเวลาเดียวกันจะต้องถูกขัดจังหวะ " หากเราปล่อยคลอรีนจำนวนมากเข้าไปในอากาศมันจะกลายเป็นหายนะที่แท้จริง สิ่งนี้ประสบกองกำลังแองโกล - ฝรั่งเศสในช่วงสงครามโลกครั้งที่สอง ในเช้าวันที่ 22 เมษายน 2458 คำสั่งของเยอรมันตัดสินใจที่จะโจมตีก๊าซครั้งแรกในประวัติศาสตร์ของสงคราม: เมื่อลมพัดที่ด้านข้างของศัตรูบนส่วนขนาดเล็กหกกิโลเมตรของด้านหน้าในพื้นที่ของ เมืองเบลเยียมของ IPRS, 5730 กระบอกสูบวาล์วถูกเปิดในเวลาเดียวกันซึ่งแต่ละอันมีคลอรีนเหลว 30 กิโลกรัม ภายใน 5 นาทีคลาวด์สีเขียวเหลืองขนาดใหญ่นั้นเกิดขึ้นซึ่งค่อยๆทิ้งร่องลึกของเยอรมันไปยังพันธมิตร ทหารอังกฤษและฝรั่งเศสกลับกลายเป็นผู้พิการอย่างสมบูรณ์ แก๊สทะลุรอยแตกในที่พักพิงทั้งหมดไม่มีความรอดจากเขา: เพราะหน้ากากป้องกันแก๊สพิษยังไม่ได้คิดค้น เป็นผลให้มีการวางยาพิษ 15,000 คนซึ่ง 5 พันถึงตาย ในหนึ่งเดือนในวันที่ 31 พฤษภาคมชาวเยอรมันทำซ้ำการโจมตีก๊าซในแนวรบด้านตะวันออก - กับกองทัพรัสเซีย มันเกิดขึ้นในโปแลนด์ที่เมือง Bolimov ที่ด้านหน้า 12 กม. จาก 12,000 กระบอกสูบ 264 ตันของคลอรีนส่วนผสมที่มีพิษมากขึ้นอย่างมีนัยสำคัญ (ถ่านหินกรดคลอไรด์ COCL 2) ได้รับการปล่อยตัว คำสั่งของ Royal รู้เกี่ยวกับสิ่งที่เกิดขึ้นระหว่าง IPR และอย่างไรก็ตามทหารรัสเซียไม่มีวิธีการป้องกัน! อันเป็นผลมาจากการโจมตีก๊าซสูญเสียมีจำนวน 9146 คนซึ่งมีเพียง 108 เพียง 108 อันเป็นผลมาจากปืนไรเฟิลและปืนใหญ่ที่มีปืนใหญ่ส่วนที่เหลือถูกวางยาพิษ ในเวลาเดียวกัน 1183 คนเสียชีวิตเกือบจะในทันที
ในไม่ช้านักเคมีระบุวิธีการหลบหนีจากคลอรีน: จำเป็นต้องหายใจผ่านผ้าพันแผลผ้าพันแผลที่ชุบด้วยโซลูชั่นโซเดียมเธียเตอร์ (สารนี้ใช้ในภาพถ่ายมันมักจะเรียกว่า hyposulfite) คลอรีนทำปฏิกิริยาอย่างรวดเร็วด้วยวิธีแก้ปัญหาของ thiosulfate ออกซิไดซ์:
NA 2 S 2 O 3 + 4CL 2 + 5H 2 O ® 2H 2 SO 4 + 2NACL + 6HCL แน่นอนว่ากรดซัลฟิวริกยังไม่เป็นสารที่ไม่เป็นอันตราย แต่สารละลายน้ำที่เจือจางนั้นอันตรายน้อยกว่าคลอรีนพิษ ดังนั้น Thiosulfate ในปีที่ผ่านมาปรากฏชื่ออื่น - "Antichlor" แต่หน้ากากก๊าซ Thiosulfate แรกมีประสิทธิภาพเพียงเล็กน้อย
ในปี 1916 นักเคมีชาวรัสเซียนักวิชาการในอนาคตนิโคไล Dmitrievich Zelinsky คิดค้นหน้ากากป้องกันแก๊สพิษที่มีประสิทธิภาพอย่างแท้จริงซึ่งสารพิษถูกควบคุมด้วยชั้นของถ่านถ่าน้ำไบัด ถ่านหินที่มีพื้นผิวที่พัฒนามากสามารถชะลอคลอรีนได้มากกว่าผ้ากอซที่ชุบด้วย hyposulphite โชคดีที่ "การโจมตีคลอรีน" ยังคงเป็นเพียงตอนที่น่าเศร้าในประวัติศาสตร์ หลังจากสงครามโลกครั้งที่คลอรีนมีอาชีพที่สงบสุขเท่านั้น
การใช้คลอรีน
ทุกปีมีคลอรีนจำนวนมาก - หลายสิบล้านตัน เฉพาะในสหรัฐอเมริกาภายในสิ้นศตวรรษที่ 20 ทุก ๆ ปีมีคลอรีนประมาณ 12 ล้านตันจากอิเล็กโทรไลซิส (อันดับที่ 10 ของอุตสาหกรรมเคมี) มวลหลักของมัน (สูงถึง 50%) ใช้กับคลอรีนของสารประกอบอินทรีย์ - เพื่อให้ได้ตัวทำละลาย, ยางสังเคราะห์, โพลีไวนิลคลอไรด์และพลาสติกอื่น ๆ , ยางคลอโรพรีน, ยาฆ่าแมลง, ยาเสพติด, ผลิตภัณฑ์ที่จำเป็นและมีประโยชน์อื่น ๆ อีกมากมาย ส่วนที่เหลือจะถูกบริโภคสำหรับการสังเคราะห์คลอไรด์อนินทรีย์ในอุตสาหกรรมเยื่อกระดาษและกระดาษเพื่อการฟอกสีฟันของไม้สำหรับการทำน้ำให้บริสุทธิ์ ในปริมาณที่ค่อนข้างเล็กคลอรีนใช้ในอุตสาหกรรมโลหะ ด้วยโลหะที่สะอาดมากได้รับ - ไทเทเนียม, ดีบุก, แทนทาลัม, ไนโอเบียม การเผาไหม้ของไฮโดรเจนในคลอรีนจะได้รับจากคลอไรด์และกรดไฮโดรคลอริกได้รับจากมัน คลอรีนยังใช้สำหรับการผลิตสารฟอกสี (hypochlorites, chlorine lime) และการฆ่าเชื้อโรคในน้ำที่มีคลอรีน
Ilya Leenson
วิธีการอุตสาหกรรมหลักของการได้รับคือ NACL ที่เข้มข้น (รูปที่ 96) ในเวลาเดียวกันมันถูกปล่อยออกมา (2SL '- 2E- \u003d CL 2) และในพื้นที่แคโทด (2n · + 2E - \u003d H 2) ได้รับการปล่อยตัวและฟอร์ม Naoh
ด้วยห้องปฏิบัติการที่ได้รับมักใช้การกระทำของ MNO 2 หรือ KMNO 4 เมื่อ:
MNO 2 + 4NSL \u003d MNSL 2 + CL 2 + 2N 2
2KMNO 4 + 16NSL \u003d 2XL + 2MNSL 2 + 5OL 2 + 8H 2 O
โดยฟังก์ชั่นทางเคมีลักษณะของมันก็เป็นโลหะที่มีการเปลี่ยนแปลงแบบ Monovalent อย่างไรก็ตามมันน้อยกว่านั้น ดังนั้นหลังสามารถมองออกจากสารประกอบได้
การโต้ตอบกับซอฟต์แวร์ H 2 + CL 2 \u003d 2HCL + 44 KCAL
ภายใต้สภาวะปกติจะใช้เวลาช้ามาก แต่เมื่อส่วนผสมมีความร้อนหรือแสงที่แข็งแกร่ง (แสงแดดโดยตรงการเผาไหม้ ฯลฯ ) มาพร้อมกับ
nacl + h 2 so 4 \u003d nahso 4 + hcl
NACL + NAHSO 4 \u003d NA 2 SO 4 + HCL
คนแรกของพวกเขาจะได้รับการดำเนินการบางส่วนภายใต้สภาวะปกติและมุ่งเป้าไปที่ความร้อนต่ำ ที่สองจะดำเนินการที่สูงขึ้นเท่านั้น สำหรับกระบวนการประสิทธิภาพการทำงานที่ยอดเยี่ยมเชิงกล
CL 2 + H 2 O \u003d HCL + NOSL
การเชื่อมต่อที่ไม่เสถียรจมูกสลายตัวช้าแม้ในการเจือจางเช่นนี้ เรียกว่ากรด Chlorothic หรือ จมูกเองและมันแข็งแกร่งมาก
เพื่อให้บรรลุเป้าหมายนี้เป็นวิธีที่ง่ายที่สุดในการเพิ่มลงในส่วนผสมของปฏิกิริยา เนื่องจากตามที่พบมันจะเกี่ยวข้องกับสิ่งที่ถูกต้องใช้เช่น Naoh มี:
CL 2 + H 2 O<–––> NOSL + HCL
Hocl + NSL + 2NAOH ---\u003e Naocl + NACL + 2H 2 O
หรือโดยทั่วไป:
CL 2 + 2NAOH ---\u003e Naocl + NACL + N 2
อันเป็นผลมาจากการมีปฏิสัมพันธ์กับปรากฎว่าเป็นส่วนผสมของ Chlorothy และ การขึ้นรูป (") มีคุณสมบัติออกซิเดชันที่แข็งแกร่งและใช้กันอย่างแพร่หลายสำหรับการฟอกสีและ
1) จมูก \u003d NSL + O
2) 2'sl \u003d h 2 o + sl 2
3) 3HOCL \u003d 2NCL + NSLO 3
กระบวนการทั้งหมดเหล่านี้สามารถดำเนินการต่อได้พร้อมกัน แต่ความเร็วสัมพัทธ์ของพวกเขาขึ้นอยู่กับเงื่อนไขที่มีอยู่อย่างมาก ด้วยการเปลี่ยนหลังเป็นไปได้ที่จะทำให้แน่ใจว่าการเปลี่ยนแปลงจะไปเกือบจะมีเป้าหมายที่หนึ่งทิศทาง
ภายใต้การกระทำของการสลายตัวของแสงแดดโดยตรงไปในครั้งแรกของพวกเขา นอกจากนี้ยังไหลต่อหน้าการติดตั้งได้ง่ายและบางอย่าง (เช่น ")
การสลายตัวของจมูกในประเภทที่สามเป็นเรื่องง่ายโดยเฉพาะอย่างยิ่งเมื่อได้รับความร้อน ดังนั้นการกระทำที่ร้อนจัดโดยสมการทั้งหมด:
ZSL 2 + 6Con \u003d KCLO 3 + 5XL + 3N 2 O
2XLO 3 + H 2 C 2 O 4 \u003d K 2 CO 3 + CO 2 + H 2 O + 2CLO 2
ไดออกไซด์สีเขียวสีเขียวอมเขียวถูกสร้างขึ้น (PL. - 59 ° C, T KIP. + 10 ° C) ฟรี Clo 2 ทนต่ำและสามารถย่อยสลายด้วย