Komparativne karakteristike kompetitivne i nekonkurentne inhibicije. Inhibitori enzima. Regulacija tipa povratne sprege
Pročitajte također
Razlikovati reverzibilnu i ireverzibilnu inhibiciju. Ako inhibitor uzrokuje trajne promjene u prostornoj tercijarnoj strukturi molekula enzima ili modifikaciju funkcionalnih grupa enzima, tada se ova vrsta inhibicije naziva ireverzibilnom. Češće, međutim, postoji reverzibilna inhibicija, podložna kvantitativnom proučavanju na osnovu Michaelis-Menten jednačine. Reverzibilna inhibicija se pak dijeli na kompetitivnu i nekompetitivnu, ovisno o tome da li je moguće ili nije moguće prevladati inhibiciju enzimske reakcije povećanjem koncentracije supstrata.
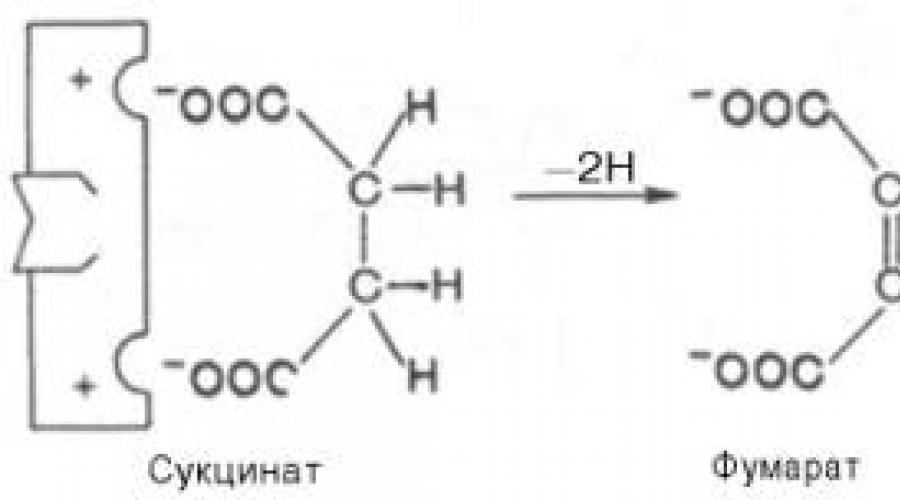
Kompetitivnu inhibiciju mogu uzrokovati supstance koje imaju strukturu sličnu strukturi supstrata, ali malo drugačiju od strukture pravog supstrata. Ova inhibicija se zasniva na vezivanju inhibitora za (aktivni) centar za vezivanje supstrata. Klasičan primjer ove vrste inhibicije je inhibicija sukcinat dehidrogenaze (SDH) malonskom kiselinom. Ovaj enzim katalizira oksidaciju dehidrogenacijom jantarna kiselina(sukcinat) do fumarne:
Ako se mediju doda malonat (inhibitor), tada će, kao rezultat njegove strukturne sličnosti sa pravim sukcinatom supstrata (prisustvo dvije iste jonizirane karboksilne grupe), on stupiti u interakciju s aktivnim centrom kako bi se formirao enzim- inhibitorni kompleks, ali to u potpunosti isključuje prijenos atoma vodika iz malonata... Strukture supstrata (sukcinata) i inhibitora (malonata) su još uvijek donekle različite. Stoga se natječu za vezivanje sa aktivnim mjestom, a stupanj inhibicije će biti određen omjerom koncentracija malonata i sukcinata, a ne apsolutnom koncentracijom inhibitora. Tako se inhibitor može reverzibilno vezati za sferu, formirajući kompleks enzim-inhibitor. Ova vrsta inhibicije se ponekad naziva inhibicija metaboličkog antagonizma (Slika 4.20).
V opšti oblik reakcija interakcije inhibitora sa enzimom može se predstaviti sljedećom jednadžbom:
Nastali kompleks, nazvan enzimsko-inhibicijski kompleks EI, za razliku od enzim-supstratnog kompleksa ES, ne razgrađuje se formiranjem produkta reakcije. Konstanta disocijacije EI kompleksa, ili inhibitorna konstanta K i, može se, prema Michaelis – Men-ten teoriji, definirati kao omjer konstanti reverzne i direktne reakcije:
Metoda kompetitivne inhibicije našla je široku primjenu u medicinskoj praksi. Poznato je, na primjer, da za liječenje nekih zarazne bolesti uzrokovane bakterijama, koriste se sulfa lijekovi. Pokazalo se da ovi lijekovi imaju strukturnu sličnost sa sparaaminobenzojevom kiselinom koju bakterijska stanica koristi za sintezu folne kiseline koja je sastavni dio
Rice. 4.20. Djelovanje kompetitivnog inhibitora (šema prema V.L.Kretovichu). E - enzim; S - podloga; R 1 i R 2 - produkti reakcije; Ja sam inhibitor.
enzimi bakterija. Zbog ove strukturne sličnosti, sulfonamid blokira djelovanje enzima istiskivanjem para-aminobenzojeve kiseline iz kompleksa s enzimom koji sintetiše folna kiselina, što dovodi do inhibicije rasta bakterija.
Nekonkurentnu inhibiciju uzrokuju supstance koje nemaju strukturnu sličnost sa supstratima i često se ne vezuju za aktivno mjesto, već za drugu lokaciju u molekuli enzima. Stepen inhibicije u mnogim slučajevima određen je trajanjem djelovanja inhibitora na enzim. Kod ove vrste inhibicije, zbog formiranja stabilne kovalentna veza enzim često prolazi kroz potpunu inaktivaciju, a zatim inhibicija postaje nepovratna. Primjer ireverzibilne inhibicije je djelovanje jodoacetata, DPP, kao i dietil-n-nitrofenil fosfata i soli cijanovodonične kiseline. Ovo djelovanje se sastoji u vezivanju i onemogućavanju funkcionalnih grupa ili metalnih jona i molekula enzima.
Sadržaj predmeta "Inhibicija. Ćelija.":
U ovom slučaju, supstanca koja je bliska po svom strukturu na zajednički enzimski supstrat, vezuje se za aktivni centar enzima, ali ne može reagovati s njim. Budući da je ovdje, blokira pristup aktivnom centru za bilo koji molekul pravog supstrata.
Budući da se u ovom slučaju inhibitor i supstrat nadmeću za mjesto na aktivni centar enzima Ovaj oblik inhibicije naziva se kompetitivna inhibicija. Za kompetitivnu inhibiciju karakteristično je da ako se koncentracija supstrata povećava, tada se povećava i brzina reakcije, odnosno ova inhibicija je reverzibilna.
Slika ilustruje jednu od primjeri kompetitivne inhibicije.
Fenomen kompetitivne inhibicije pomaže razumjeti mehanizam djelovanja nekih lijekova, posebno sulfonamida. Cilj hemoterapije je uništavanje uzročnika bolesti uz pomoć određenih hemikalija bez oštećenja tkiva organizma domaćina. Prvi takvi lijekovi bili su sulfonamidi, čije je antibakterijsko djelovanje otkriveno 30-ih godina XX vijeka. Tokom Drugog svjetskog rata bili su naširoko korišteni u borbi protiv infekcija rana. Sulfonamidi su hemijski bliski paraaminobenzovoj kiselini (PABA), neophodnom faktoru rasta za mnoge patogene bakterije... PABA je potrebna bakterijama za sintezu folne kiseline, koja služi kao jedan od kofaktora enzima u njima. Sulfonamidi inhibiraju jedan od enzima uključenih u sintezu folne kiseline iz PABA.
Životinjske ćelije neosetljivi na sulfonamide, iako im je potrebna folna kiselina za neke reakcije. To se objašnjava činjenicom da koriste već formiranu folnu kiselinu; nemaju metabolički put koji bi osigurao njegovu sintezu.
Nekonkurentna reverzibilna inhibicija
Inhibitori ovog tipa nisu po svojoj strukturi povezani sa supstratom ovog enzima; U ovom slučaju u stvaranju kompleksa s inhibitorom ne sudjeluje aktivni centar enzima, već neki drugi dio njegove molekule. Ovo ne ometa vezivanje supstrata za enzim, ali onemogućava katalizu.
Sa usponom koncentracija inhibitora brzina reakcije je sve niža i niža. Do trenutka zasićenja inhibitorom, ispada da je praktički nula. Za razliku od kompetitivne inhibicije, u ovom slučaju povećanje koncentracije supstrata ne utječe na brzinu reakcije.
Inhibicija
Je inhibicija aktivnosti enzima. U tom slučaju ne dolazi do denaturacije enzima.
Inhibitor - supstanca koja uzrokuje specifično smanjena aktivnost enzim. Neorganske kiseline i teški metali nisu inhibitori, ali jesu inaktivatori, jer smanjuju aktivnost bilo kojih enzima, tj. čin nespecifično Denaturirajuća sredstva se ne nazivaju i inhibitorima.
Inhibitori: joni ili mali molekuli koji čine dio enzimskog regulatornog sistema, kao i farmakološki lijekovi.
po jačini vezivanja enzima za inhibitor, inhibicija je reverzibilno i nepovratan.
U odnosu na odnos inhibitora i aktivnog mesta enzima, inhibicija se deli na konkurentan i nekonkurentan.
Tipovi inhibicije
1. Reverzibilno 2. Nepovratno
A. KONKURENTNO A. SPECIFIČNO
B. NEKONKURENCIJSKI B. NESPECIFIČAN
Reverzibilna inhibicija. Većina inhibitora djeluje reverzibilno na formiranje nekovalentne veze sa enzimom, a pod određenim uvjetima disociraju s obnavljanjem aktivnosti enzima.
Kompetitivna inhibicija.Inhibitor je sličan enzimskom supstratu po svojoj strukturi i takmiči se sa supstratom za aktivni centar ( nalazi se u aktivnom centru enzima), što dovodi do smanjenja vezivanja supstrata za enzim i poremećaja katalize. Ovo je karakteristika kompetitivne inhibicije - sposobnost pojačavanja ili slabljenja inhibicije kroz promjenu koncentracije supstrata.
Za kompetitivni tip inhibicije važe sljedeće jednačine:
E + S ⇔ ES → E + P,
1. Konkurentska interakcija etanol i metanol za aktivni centar alkohol dehidrogenaza.
2. Inhibicija sukcinat dehidrogenaza sa malonskom kiselinom, čija je struktura slična strukturi supstrata ovog enzima - jantarne kiseline (sukcinata).

Sukcinat + FAD ----------- Fumarat + FADN 2
3. Kompetitivni inhibitori takođe uključuju antimetabolite ili pseudosubstrate, kao što su antibakterijski agensi. sulfonamidi po strukturi sličan NS-aminobenzojeva kiselina, komponenta folne kiseline. Pri liječenju sulfonamidima u bakterijskoj stanici, upotreba NS-aminobenzojeva kiselina za sintezu folna kiselina, što izaziva terapeutski efekat.

Sličnost strukture sulfonamida i para-aminobenzojeve kiseline, komponente vitamina B9

Utjecaj različitih koncentracija supstrata na brzinu reakcije koju kataliziraju enzimi 1 i2 (u prisustvu inhibitora): a) hiperbolička zavisnostVod [S], b) direktna zavisnost u inverznim koordinatama 1 /Vod 1 / [S] - Lineweaver-Burke.
Kompetitivni inhibitori smanjuju brzinu hemijske reakcije. Kompetitivni inhibitor povećava K m za dati supstrat (smanjuje afinitet supstrata za enzim). To znači da u prisustvu kompetitivnog inhibitora potrebna je visoka koncentracija supstrata za postizanje 1/2 V max. Povećanje omjera koncentracije supstrata i inhibitora smanjuje stupanj inhibicije. Pri značajno većim koncentracijama supstrata, inhibicija potpuno nestaje., jer će aktivni centri svih molekula enzima biti pretežno u kompleksu sa supstratom.
Nekonkurentna inhibicija.Inhibitornema strukturna sličnost sa podlogom ipridružuje se ne u aktivnom centru, i na drugom mjestu molekula, istovremeno sa supstratom. Formira se trostruki kompleks: supstrat - enzim - inhibitor. To dovodi do deformacije aktivnog mjesta i katalitičke aktivnosti. Na primjer, cijanovodonična kiselina (cijanidi) vezuje se za hem gvožđe enzima respiratornog lanca i blokira ćelijsko disanje.

Kinetička ovisnost nekompetitivne inhibicije: karakterizira smanjenje V max enzimske reakcije i smanjenje afiniteta supstrata za enzim, tj. povećanje K m.

Nekonkurentna inhibicija u dvostrukim recipročnim koordinatama pri različitim koncentracijama inhibitora (1 - [I] = 0; 2 - [I]> 0; 3 - [I]> [I] 2).
S nekompetitivnom inhibicijom, Michaelisova konstanta se ne mijenja, a maksimalna brzina reakcije se smanjuje za (1 + [ I]/K i) jednom. Dakle, u dvostrukim recipročnim koordinatama, familija pravih linija koje odgovaraju različitim koncentracijama inhibitora seku se u jednoj tački na apscisi.Ireverzibilna inhibicija se uočava u slučaju stvaranja kovalentnih stabilnih veza između molekula inhibitora i enzima. Najčešće se aktivni centar enzima mijenja. Kao rezultat toga, enzim ne može obavljati katalitičku funkciju.
Ireverzibilni inhibitori uključuju jone teških metala, na primjer, živu (Hg 2+), srebro (Ag +) i arsen (As 3+), koji u niskim koncentracijama blokiraju sulfhidrilne grupe aktivnog mjesta. U ovom slučaju, supstrat se ne može podvrgnuti hemijskoj transformaciji (Sl. 2-26). U prisustvu reaktivatora, obnavlja se enzimska funkcija. U visokim koncentracijama ioni teških metala uzrokuju denaturaciju proteinske molekule enzima, tj. dovesti do potpune inaktivacije enzima.
Orenburg - 2010
1.1 Reverzibilna inhibicija
1.1.2 Nekonkurentna inhibicija
1.1.3 Nekonkurentna inhibicija
1.2 Nepovratna inhibicija
1.3 Alosterična inhibicija
2. Nova vrsta inhibicija enzimske aktivnosti
3. Upotreba inhibitora enzima
ZAKLJUČAK
Spisak korišćene literature
1. Inhibitori enzima. Vrste inhibicije enzimske aktivnosti
Poznato je da se aktivnost enzima može relativno lako smanjiti različitim djelovanjem. Takvo smanjenje brzine enzimskih reakcija obično se naziva inhibicijom aktivnosti ili inhibicijom enzima.
Slika 1. Šema aktivacije i inhibicije delovanja enzima (prema Yu. B. Filippovich): a. - alosterični centar enzima; K - katalitički centar; c - centar podloge
Enzimi su proteini, odnosno njihova aktivnost se može smanjiti ili potpuno eliminirati djelovanjem koje dovodi do denaturacije proteina (zagrijavanje, djelovanje koncentriranih kiselina, lužina, soli teških metala itd.) nije od posebnog interesa za proučavanje njihovog mehanizma. Mnogo važnije je proučavanje inhibicije upotrebom supstanci koje specifično i obično u malim količinama stupaju u interakciju sa enzimima - inhibitorima enzima. Dešifrovanje mehanizama mnogih bioloških procesa, kao što su glikoliza, Krebsov ciklus i drugi, postalo je moguće samo kao rezultat upotrebe specifičnih inhibitora različitih enzima (N.E. Kucherenko, Yu.D. Babenyuk et al., 1988).
Neki inhibitori enzima su efikasne lekovite supstance za organizam životinja i ljudi, dok su drugi smrtonosni otrovi (V.P. Komov, V.N. Švedova, 2004).
Inhibitori stupaju u interakciju s aktivnim centrima molekula enzima, inaktivirajući funkcionalne grupe proteina. Mogu stupiti u interakciju s metalima koji su dio molekula enzima i kompleksa enzim-supstrat, inaktivirajući ih. Visoke koncentracije inhibitora uništavaju kvartarne, tercijarne i sekundarne strukture molekula enzima, uzrokujući njegovu denaturaciju (A.I. Kononsky, 1992).
Nedavno su otkriveni antienzimi (antienzimi ili antizimi), koji su proteini koji djeluju kao inhibitori enzima. Takve supstance uključuju, na primjer, inhibitor tripsina koji se nalazi u zrnu soje i serumski antitripsin. Anti-enzim ornitin dekarboksilaza nedavno je otkriven u jetri životinja. Antizimi, najvjerovatnije, formiraju komplekse koji se teško razdvajaju s odgovarajućim enzimima, isključujući ih iz kemijskih reakcija. Ponekad je inhibitor sastavnu komponentu prekursor enzima, ili je dio složenih enzimskih kompleksa. Međutim, još nije razjašnjeno da li su takvi antienzimi pravi inhibitori ili regulatorne podjedinice.
Ako inhibitor uzrokuje trajne promjene u prostornoj tercijarnoj strukturi molekula enzima ili modifikaciju funkcionalnih grupa enzima, tada se ova vrsta inhibicije naziva ireverzibilnom. Češće, međutim, postoji reverzibilna inhibicija, podložna kvantitativnom proučavanju na osnovu Michaelis-Menten jednačine. Reverzibilna inhibicija se, pak, dijeli na konkurentsku i nekonkurentnu
U praksi, mnogi inhibitori ne pokazuju svojstva koja su karakteristična za čisto kompetitivnu ili čisto nekompetitivnu inhibiciju. Drugi način klasifikacije inhibitora zasniva se na prirodi njihovog mjesta vezivanja. Neki od njih se vezuju za enzim na istom mestu kao i supstrat (u katalitičkom centru), dok drugi - na znatnoj udaljenosti od aktivnog centra (u alosteričnom centru) (R. Murray, D. Grenner et al., 1993).
1.1 Reverzibilna inhibicija
Postoje tri vrste reverzibilne inhibicije enzima: kompetitivna, nekonkurentna i nekonkurentna, ovisno o tome da li je moguće ili nije moguće prevladati inhibiciju enzimske reakcije povećanjem koncentracije supstrata.
1.1.1 Kompetitivna inhibicija
Kompetitivni inhibitor se natječe sa supstratom za vezivanje za aktivno mjesto, ali za razliku od supstrata, kompetitivni inhibitor vezan za enzim ne prolazi kroz enzimsku konverziju. Prepoznatljiva karakteristika kompetitivna inhibicija je da se može eliminisati ili oslabiti jednostavnim povećanjem koncentracije supstrata. Na primjer, ako je aktivnost enzima potisnuta za 50% pri datim koncentracijama supstrata i kompetitivnog inhibitora, tada možemo smanjiti stupanj inhibicije povećanjem koncentracije supstrata.
U svojoj trodimenzionalnoj strukturi, kompetitivni inhibitori obično liče na supstrat ovog enzima. Zbog ove sličnosti, kompetitivni inhibitor uspijeva "prevariti" enzim i vezati se za njega. Konkurentska inhibicija se može kvantificirati na osnovu Michaelis-Menten teorije. Kompetitivni inhibitor I jednostavno se reverzibilno vezuje za enzim E, formirajući s njim kompleks
Konkurentska inhibicija se najlakše može eksperimentalno prepoznati određivanjem učinka koncentracije inhibitora na ovisnost početne brzine reakcije o koncentraciji supstrata. Da bi se razjasnilo pitanje do koje vrste - kompetitivne ili nekonkurentne - dolazi do reverzibilne inhibicije enzima, koristi se metoda dvostrukih recipročnih vrijednosti. Iz grafova konstruiranih u dvostrukim inverznim koordinatama moguće je odrediti i vrijednost konstante disocijacije kompleksa inhibitora enzima (vidi sliku 1) (A. Leinger, 1985.)
Kompetitivnu inhibiciju mogu uzrokovati supstance koje imaju strukturu sličnu strukturi supstrata, ali malo drugačiju od strukture pravog supstrata. Ova inhibicija se zasniva na vezivanju inhibitora za (aktivni) centar za vezivanje supstrata (vidi sliku 2).

Rice. 2. Opšti princip kompetitivna inhibicija (šema prema V.L. Kretovichu). E - enzim; S - podloga; R 1 i R 2 - produkti reakcije; Ja sam inhibitor.
Primjer je učinak malonske kiseline na reakciju kataliziranu sukcinat dehidrogenazom i povezana s konverzijom jantarne kiseline u fumarnu kiselinu. Dodavanje malonske kiseline u reakcijsku smjesu smanjuje ili potpuno zaustavlja enzimsku reakciju, budući da je kompetitivni inhibitor sukcinat dehidrogenaze. Sličnost malonske kiseline sa jantarnom kiselinom dovoljna je za stvaranje kompleksa sa enzimom, ali do razgradnje ovog kompleksa ne dolazi. S povećanjem koncentracije jantarne kiseline, ona istiskuje malonsku kiselinu iz kompleksa, kao rezultat toga, obnavlja se aktivnost sukcinat dehidrogenaze.

Rice. 3. Kompetitivna inhibicija reakcije pretvaranja jantarne kiseline u fumarnu kiselinu pod dejstvom malonske kiseline.
Strukture supstrata (sukcinata) i inhibitora (malonata) su još uvijek donekle različite. Stoga se natječu za vezivanje sa aktivnim mjestom, a stupanj inhibicije će biti određen omjerom koncentracija malonata i sukcinata, a ne apsolutnom koncentracijom inhibitora. Dakle, inhibitor se može reverzibilno vezati za enzim i formirati kompleks enzim-inhibitor. Ova vrsta inhibicije se ponekad naziva inhibicija metaboličkog antagonizma (vidi sliku 3).
U opštem obliku, reakcija interakcije inhibitora sa enzimom može se predstaviti sledećom jednadžbom:

Nastali kompleks, nazvan enzimsko-inhibicijski kompleks EI, za razliku od enzim-supstratnog kompleksa ES, ne razgrađuje se formiranjem produkta reakcije.
Mnogi lekovite supstance inhibiraju ljudske i životinjske enzime na kompetitivni način. Na primjer, sulfa lijekovi se koriste za liječenje nekih zaraznih bolesti uzrokovanih bakterijama. Pokazalo se da ovi lijekovi imaju strukturnu sličnost s paraaminobenzojevom kiselinom, koju bakterijska stanica koristi za sintezu folne kiseline, koja je sastavni dio bakterijskih enzima. Zbog ove strukturne sličnosti, sulfanilamid blokira djelovanje enzima istiskivanjem para-aminobenzojeve kiseline iz kompleksa sa enzimom koji sintetizira folnu kiselinu, što dovodi do inhibicije rasta bakterija.

Struktura peptidoglikana bakterijske ćelijske stijenke uključuje D-alanin, koji je odsutan u tijelu životinja i ljudi. Da bi sintetizirale ćelijski zid, bakterije koriste enzim alanin-racemazu da pretvore životinjski L-alanin u D-oblik. Alanin racemaza je karakteristična za bakterije i ne nalazi se kod sisara. Stoga predstavlja dobru metu za inhibiciju droge... Zamjena fluora za jedan od protona metilne grupe daje fluoroalanin, na koji se veže alanin racemaza, što dovodi do njegove inhibicije.